Статистика заболеваемости остеопорозом производит тягостное впечатление. После 50 лет каждая третья женщина страдает этим заболеванием. При этом зачастую происходят опасные травмы. До 36 процентов больных с переломами шейки бедра умирают в течение одного года. В основном это заболевание поражает женщин в постменопаузе, но встречается и у людей в молодом возрасте. Вы можете узнать об этом в статье «Остеопороз – проблема пожилых: смириться или лечиться?» В ней описывается новый метод диагностики остеопороза. Также авторы публикации рассказали про инновационный препарат для здоровья костей. Подробно рассматривается трабекулярный отдел костной ткани.
Остеопороз – это опасная болезнь сама по себе. Дополнительную сложность представляет то, что в пожилом возрасте у многих людей имеется уже не по одному заболеванию. Очень часто встречаются расстройства эндокринной и сердечно-сосудистой системы. Когда больной употребляет сразу пять-шесть таблеток, в том числе остепротекторы, это может привести к ятрогенной патологии. Поэтому необходимо развивать методы диагностики остеопороза, создавать эффективные препараты для здоровья костей.
Трабекулярный отдел костной ткани
Костная ткань состоит из двух отделов – кортикального (сплошного), а также трабекулярного (губчатого). Обычно диагностика остеопороза проводится с помощью 2-фотонной рентгеновской абсорбциометрии, которая направлена на установление минеральной плотности костной кортикальной ткани. При этом данная характеристика не всегда дает возможность правильно установить диагноз. Все больше специалистов считают, что нужно диагностировать также и состояние трабекулярного отдела костной ткани.
Дело в том, что различные процессы в нем происходят намного быстрее, чем в остальной кости. При этом заболевании большое значение имеет своевременность и точность диагноза. Российские ученые внесли заметный вклад в изучение остеопороза. Они уверены, что пора менять классификацию данного заболевания по ВОЗ, поскольку при диагностике важно определять микроархитектонику трабекулярного отдела кости.
Такие изменения необходимо проводить, поскольку порой при лечении остеопротекторам увеличивается не только минеральная плотность костей, но и растут полостные образования. Поэтому сотрудники Центра разработали инновационный метод рентгеноморфометрической диагностики остеопороза. Он позволяет не только выявить заболевание на ранней стадии, но и оценить эффективность лекарственного препарата.
Чтобы протестировать открытие, медики провели исследование на базе этого центра. С 2009 по 2013 года ученые обследовали 80 женщин старше 51 года, у которых обнаружена андрогенная недостаточность, что является предвестником остеопороза. Перед началом проведения эксперимента женщин разделили на три группы.
Определяли минеральную плотность ткани, микроархитектонику, состояние трабекулярных отделов костей. В основном применялся аппарат «Остеометр» DTX-100, а также специально разработанная компьютерная программа (TBS-шкала). Она позволяет составлять графическое изображение пораженных участков. Также авторы статьи проводили лабораторное обследование – определяли уровень тестостерона в крови.
В первой группе женщины принимали препарат «Остеомед», который содержит продукт пчеловодства – трутневый расплод. Этот витаминный комплекс полезен для здоровья костной ткани. Остальные лекарства использовались для сравнения. Во второй группе пили карбонат кальция иностранного производства. В третьей больным давали ранелат стронция.
Через десять месяцев после завершения терапии провели повторное обследование. В итоге выяснилось, что наиболее положительный эффект от препарата получили больные в первой группе. Так, у 19 женщин полости уменьшились в размере, а у 10 закрылись полностью. Полученные результаты означают, что остеопороз вполне можно победить. Доказано, что препарат «Остеомед» улучшил здоровье костей.
Врач, №6, 2014
«Остеопороз – проблема пожилых: смириться или лечиться?»
д.м.н., профессор В. Струков, д.м.н., профессор В. Потапов,
д.м.н., профессор А. Кислов, дд.м.н., профессор И. Бойков,
Д. Елистратов, к.м.н. М. Баженов, к.м.н. Ю. Семерич,
к.б.н. Л. Бурмистрова, к.м.н. Н. Еремина, М. Максимова
Содержание
Остеопороз – проблема пожилых: смириться или лечиться?
 Остеопороз как самостоятельное заболевание выделено в конце 1990-х годов. ВОЗ определила остеопороз как системное метаболическое заболевание костей, характеризующееся снижением минеральной плотности кости (МПК) на 2,5 стандартных отклонения от среднего значения пиковой костной массы у здоровых людей молодого возраста, нарушением микроархитектоники с повышенной ломкостью костей и склонностью к переломам.
Остеопороз как самостоятельное заболевание выделено в конце 1990-х годов. ВОЗ определила остеопороз как системное метаболическое заболевание костей, характеризующееся снижением минеральной плотности кости (МПК) на 2,5 стандартных отклонения от среднего значения пиковой костной массы у здоровых людей молодого возраста, нарушением микроархитектоники с повышенной ломкостью костей и склонностью к переломам.
Остеопороз — в основном болезнь пожилых, однако предпосылки к его развитию закладываются в период внутриутробного развития, а также в детском возрасте. Большое значение имеет наследственность: если в анамнезе есть указания на наличие у престарелых родственников переломов, необходимо заранее, не дожидаясь менопаузы, принять необходимые профилактические меры.
Несмотря на успехи современной медицины в диагностике, лечении и профилактике, остеопороз с его основными клиническими проявлениями — переломами тел позвоночника и шейки бедра — продолжает оставаться грозным заболеванием, приводящим в большинстве случаев к инвалидности. Актуальность проблемы остеопороза возрастает в связи с тем, что средняя продолжительность жизни в мире неуклонно увеличивается уже более 30 лет. Старение и остеопороз тесно связаны: чем старше возраст, тем чаще развивается остеопороз и возникают переломы.
Старение населения планеты в дальнейшем окажет огромное влияние на живущих людей, структуру заболеваемости и смертности. Доля дегенеративных заболеваний опорно-двигательного аппарата, к которым относится остеопороз, значительно увеличится. Известно, что после 50 лет каждая 3-я женщина страдает остеопорозом, более чем у 1/3 женщин старше 65 лет имеются переломы тел позвонков, до 36% больных с переломом шейки бедренной кости умирают в течение 1-го года, а >50% выживших становятся инвалидами.
Проблема остеопороза у пожилых осложняется тем, что, как правило, он сочетается с другими серьезными заболеваниями (сердца, сосудов, эндокринной патологией артериальной гипертензией, артритами и др.), по поводу которых больной уже получает лекарства (≥5 препаратов), назначение таким пациентам еще 2—3 остеопротекторов нередко приводит к ятрогенной патологии, а длительное их применение (фосамакс или ранелат стронция) может обусловить появление у пациентов так называемых атипичных, ранее не встречавшихся переломов, которые не лечатся [1—3]. В частности, возможен некроз костей челюсти.
Добиться успеха в лечении больных постменопаузальным остеопорозом (ПО) трудно или невозможно без учета роли сопутствующих возрастных факторов. Так, неправильное питание, отсутствие зубов, нарушение функции желудочно-кишечного тракта приводит к ухудшению переносимости молочных продуктов, уменьшению всасывания кальция. Возможны нарушения гормонального статуса, появление дефицита витамина D, гипокальциемии (из-за недостаточного пребывания на солнце) и т.д. Перечисленные факторы создают ситуацию, когда поддержание нормального уровня кальция в крови возможно только за счет усиленной резорбции костной ткани с возможностью при этом ухудшения архитектоники и возникновения переломов.
«Золотым стандартом» в диагностике остеопороза является 2-фотонная рентгеновская абсорбциометрия с определением МПК . По классификации ВОЗ, нормальная МПК по Т-критерию составляет от +1 до -1 стандартных отклонений (СО) от пиковой костной массы. Остеопения I—III степени определяется при МПК от -1 до -2,5 СО, остеопороз — в пределах -2,5 СО и менее. В соответствии с этими критериями в настоящее время и диагностируется остеопороз. Однако только по увеличению или уменьшению МПК не всегда можно правильно поставить диагноз, а тем более объективно оценить эффективность препарата в лечении остеопороза. Поэтому в последние годы большее внимание уделяется трабекулярной костной ткани, в которой все процессы протекают в 8 раз быстрее, чем в кортикальной, а значит, при оценке микроархитектоники трабекулярной кости повышается точность диагностики остеопороза и риска переломов.
Ряд исследователей указывают на необходимость пересмотра классификации остеопороза по ВОЗ и учитывать не только МПК, но и микроархитектонику. Обоснованием служит тот факт, что нередко переломы происходят при небольшом снижении МПК. Так, в 70 лет средняя МПК равна -2,5 СО, и этот показатель не всегда отражает реальный риск перелома.
Структуру трабекулярной кости можно оценить с использованием магнитно-резонансной томографии (МРТ) или послойной компьютерной томографии (КТ), но эти методы дорогостоящие и не всегда доступны в клинической практике. Поэтому для оценки качества трабекулярной костной ткани предложена TBS-шкала для тел позвонков (Trabecular Bone Score, патент компании Med-Lmaps, Франция, 2006; http://www.med-imaps.com). Такая шкала используется на остеометрах, что дешевле и доступнее. При отсутствии современных остеометров лечение проводят с учетом клинических данных, анамнеза (переломы) и показателя большого риска переломов по FRAX-шкале.
 Наши исследования показали, что более точно определить степень тяжести ПО и эффективность препарата можно только с учетом морфометрических данных [4—6]. Без этого диагноз заболевания и эффективность препарата определить затруднительно, кроме того возможно допущение ошибки, например, при атипичном остеопорозе. На рис. 1 приведен пример, когда остеометрическое исследование позволило поставить пациентке диагноз ПО, который по результатам определения МПК не ставили.
Наши исследования показали, что более точно определить степень тяжести ПО и эффективность препарата можно только с учетом морфометрических данных [4—6]. Без этого диагноз заболевания и эффективность препарата определить затруднительно, кроме того возможно допущение ошибки, например, при атипичном остеопорозе. На рис. 1 приведен пример, когда остеометрическое исследование позволило поставить пациентке диагноз ПО, который по результатам определения МПК не ставили.
Таким образом, выявление полостных образований в костях имеет важное значение для уточнения диагноза. Кроме того, положительная или отрицательная динамика размера полостей может указывать на эффективность лечебного препарата. Однако большинство современных остеометров не распознают полости и не дают представления о микроархитектонике трабекулярных костей, так как настроены только на количественное определение МПК. Полостные образования в трабекулярных костях можно выявить с использованием МРТ либо с помощью послойной КТ, что на практике не всегда доступно. Кроме того, на более ранних этапах остеопороза полости отсутствуют. Поэтому для оценки показателя качества трабекулярной костной ткани у таких пациентов нами предложена TBS-шкала для костей предплечья [7].
Исследование проводят с помощью аппарата «Остеометр» DTX-100 или DTX-200, что доступнее и дешевле, чем при использовании TBS-шкалы для тел позвонков. Необходимость такой разработки была вызвана трудностями в определении эффективности препарата для лечения остеопороза только по количественному показателю МПК. Так, у пациентки М. при лечении фосамаксом через 10 мес. МПК повысилась с -3,1 до -2,3 СО, но увеличились также и полостные образования. Поэтому если оценивать эффективность лечения по МПК, то достигнутый результат можно считать положительным, следовательно, препарат эффективен. Если же оценивать динамику заболевания с учетом морфометрии (полостей), заключение будет другим: лечение фосамаксом неэффективно, так как размеры полостных образований и риск костных переломов увеличились.
Нами с целью разработки метода рентгеноморфометрической диагностики остеопороза и способа определения эффективного препарата в лечении ПО на базе центра остеопороза Пензенского института усовершенствования врачей в 2009 — 2013 гг. обследованы 80 женщин с андрогенным дефицитом в возрасте 51 года — 87 лет.
Критерии включения в исследование: женщины с ПО, гормонально и клинически подтвержденным андрогенным дефицитом; с МПК<-2,5 СО и наличием полостных образований в трабекулярных отделах костей. МПК определяли рентгеноабсорбционным методом на аппарате «Остеометр» DTX-100, позволяющим одновременно определять не только количественные, но и морфометрические (полости и избыточное отложение солей в мягких тканях) параметры МПК. Обследование включало объективный осмотр, общеклиническое лабораторное определение общего тестостерона. Гормональное исследование проводили иммунохемилюминесцентным методом на аппарате Immulite 2000.
Тяжесть остеопороза оценивали по классификации ВОЗ, микроархитектонике, наличию полостей в трабекулярных отделах костей. Критериями оценки эффективности терапии были: способность препарата увеличивать МПК, закрывать или уменьшать размеры полостных образований в трабекулярных отделах костей; увеличение мышечной силы; снижение частоты падений; отсутствие новых переломов; повышение двигательной активности. По разработанной нами компьютерной программе (TBS-шкала для костей предплечья) на языке программирования Delphi проводили численный анализ изображений. Для этих целей графическое изображение представляли в виде 2-мерного массива данных пикселей. Вычисление площади интересуемых цветовых зон или полостей и анализ их динамики осуществляли, подсчитывая количество соответствующих пикселей. При повторном исследовании, учитывая размер исходного графического изображения, вычисляли фактическую площадь зон поражения после проведенного лечения.
В зависимости от получаемого препарата пациентки были распределены в 3 сравнимые по возрасту больных и тяжести течения заболевания группы. Больные 1-й группы (37 женщин) получали “Остеомед Форте” перорально (в 1 таблетке: цитрат Са — 500 мг, трутневый расплод — 100 мг, витамин D3 — 500 ME) по 1 таблетке утром и на ночь 3-месячными курсами 3 раза в год с 1-месячными интервалами. Разрешение этического комитета получено.
Во 2-й группе (33 женщины) применяли карбонат кальция иностранного производителя (в 1 таблетке Са — 0,5 г, витамин D3 — 500 ME) 2 раза в день такими же курсами, как в 1-й группе; в 3-й группе (10 женщин) — препарат стронция ранелат — по 1 саше (2 г/сут.) постоянно на ночь.
У всех пациентов до назначения препаратов и после терапии определяли МПК и размеры полостных образований рентгеноабсорбционным методом — визуально и по TBS-шкале.
Статистический анализ выполняли с помощью пакета программ StatSoft для Windows ХР. Данные представлены в виде М ± m , где М — среднее арифметическое, m — ошибка среднего. Различия считали статистически значимыми при р<0,05.
Через 10 мес. после завершения лечения в 1-й группе клинический эффект отмечен у 29 (78±7%) больных: у 19 (51±8%) — уменьшение размеров полостей, у 10 (27±7%) — закрытие полостей. Во 2-й группе положительные сдвиги были у 12 (36±8%) женщин, в 3-й группе выявлена положительная динамика размеров полостей у 2 (20±13%) пациенток (по сравнению с 1-й группой; р<0,05).
Более высокую эффективность в лечении остеопороза “Остеомеда Форте” можно объяснить тем, что в этом препарате содержатся гормоны трутней — субстрат для синтеза в организме пациенток собственных гормонов. Это подтвердил анализ гормональных показателей, показавший, что концентрация общего тестостерона до лечения составляла: в 1-й группе — 1,1±0,4 нмоль/л; во 2-й — 1,2+0,5 нмоль/л (при референсных значениях для данного метода 1,7—3,4 нмоль/л), но через 10 мес. терапии в 1-й группе повысилась до 2,3+0,6 нмоль/л (р<0,05), а во 2-й группе осталась без изменений. В 3-й группе достоверных изменений в гормональном статусе до и после лечения не было.
Самой низкой эффективность была при лечении стронция ранелатом (3-я группа). Это можно объяснить необходимостью более длительного лечения — до 60 мес. [8], т.е. в 3—4 раза больше, чем при терапии “Остеомедом Форте”. Кроме того, стоимость лечения стронция ранелатом составляет в месяц >2 тыс. руб., что в 4—5 раз выше, чем при терапии с применением “Остеомеда Форте”. Поскольку большинству пожилых пенсионеров стронция ранелат не подходит по цене, 3-я группа оказалась самой малочисленной. Кроме того, отмечались побочные реакции в виде диареи (у 2 больных), обострения гастрита (у 2), головной боли (у 1). Полученные данные соответствуют имеющимся в литературе.
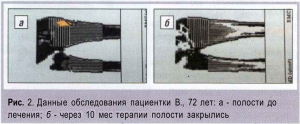 На рис. 2 представлен пример закрытия полостей у пациентки В., получавшей Остеомед Форте в течение 10 мес.
На рис. 2 представлен пример закрытия полостей у пациентки В., получавшей Остеомед Форте в течение 10 мес.
Проведенное исследование показало, что дополнительная диагностика наличия полостных образований в трабекулярных отделах и применение TBS-шкалы костей способствуют более точной верификации диагноза остеопороз. Кроме того, мониторинг морфометрических проявлений позволяет определить эффективность применяемых для лечения остеопороза препаратов. Так, из 3 исследуемых препаратов “Остеомед Форте” в наибольшей степени содействовал нормализации уровня андрогенов у женщин, что вело к улучшению общего состояния, увеличению МПК и уменьшению размеров или закрытию полостей в трабекулярных отделах. Механизм положительного влияния “Остеомеда Форте” на морфологические проявления остеопороза не изучен. Согласно мнению ряда авторов, в развитии ПО важную роль играет дефицит андрогенов [9, 10]. При ПО у женщин значительно понижается уровень всех андрогенов. Б. Калинченко и соавт. [9] указывают на необходимость использования андрогенов в лечении остеопороза. Поскольку применение естественных эстрогенов и андрогенов не лишено ряда недостатков, мы предложили использовать трутневый расплод в качестве донатора половых гормонов [10—12].
Полученные результаты позволяют заключить, что высокий лечебный эффект препарата “Остеомед Форте” обусловлен содержанием в нем трутневого расплода, стимулирующего (как донатор андрогенов) продукцию собственных половых гормонов у пациенток, что улучшает МПК. Это подтверждается повышением у женщин с ПО после курса терапии концентрации общего тестостерона в сыворотке крови с 1,1±0,4 до 2,5±0,6 нмоль/л (р<0,05). При лечении карбонатом кальция и стронция ранелатом положительных сдвигов в уровне тестостерона не отмечалось.
Дефицит половых гормонов при ПО обусловливает морфометрические изменения в трабекулярных костях с формированием полостей вследствие усиленной резорбции трабекул. Морфометрический контроль динамики полостных образований и применение ТВS-шкалы позволяют с большей точностью верифицировать диагноз остеопороза и определять наиболее эффективный препарат для конкретного больного, что способствует персонифицированному подходу в лечении остеопороза, а это особенно важно для возрастного контингента. Исследования, направленные на разработку более чувствительных технологий в диагностике остеопороза и прогнозировании переломов, способствуют также выбору более эффективного препарата для восстановления метаболизма в трабекулярной кости при ПО.
Проведенные исследования позволяют нам утверждать, что остеопороз можно не только остановить, но и уменьшить его тяжесть, снизить риск переломов. А для этого необходим персонифицированный подход.
Литература
1. Durie В., Katz М. Croweiy J. Osteonecrosis of the jaw and bifosfonates // N. Engl. J. Med. 2005; 21:99102.
2. Murad О., Arora S., Farag A. et al. Bisphosphonates and osteonecrosis of the jaw: a retrospective study // Endocr. Pract. 2007; 13 (3): 2328.
3. Montebugnoli L, Felicetti L, Gissi D. et al. Biphosphonateassociated osteonecrosis can be controlled by nonsurgical management // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2007; 104 (4): 4737.
4. Gunther C. et al. Beneficial Effect of PTH on Spine BMD and Microarchitecture (TBS) Parameters in Postmenopausal Women with Osteoporosis. A 2Year Study. Osteoporosis Int. 2012; 23 (2): 85386.
5. Hans D. et al. Beneficial Effects of Strontium Ranelate Compared to Alendronate on TBS Menopausal Osteoporotic Women. A2Year Study. Osteoporosis Int. 2012 23 (2): 85386.
6. Leslie W., Kanis J. Lumbar spine TBS is a FRAX independent risk factor for fracture. The Manitoba BMD Cohort. ISCD Annual meeting 2013. Tampa, Florida.
7. Бойков И.В., Струков В.И., Семерич Ю.С. Программа определения степени поражения пациента остеопорозом. Свидетельство о государственной регистрации программы для ЭВМ № 2013660284 от 10.09.2013.
8. Bruyere 0. et al. Strontion Ranelateon spinal osteoarthritis progression // Ann. Rheumatol. DIs. 2008; 67: 3359.
9. Kalinchenko S., Vishnevsky E., Koval A. et al. Beneficial effects of testosterone administration on symptoms of the lower urinary tract in men with lateonset hypogonadism: A pilot study // The Aging Male. 2008; 11 (2): 5761.
10. Струков В.И., Джоунс О.В., Крутяков Е.Н. и др. Способ и препарат для профилактики и лечения атипичного остеопороза с нормальной или повышенной минерализацией костной ткани с наличием полостных образований в трабекулярных отделах костей. Патент на изобретение №2497533.
11. Струков В.И., Джоунс О.В., Крутяков Е.Н., и др. Способ профилактики и лечения остеопороза и переломов костей и препарат для профилактики и лечения остеопороза и переломов костей. Патент на изобретение №2498811. Приоритет изобретения от 19.04.2012.
12. Струков В.И., Джоунс О.В., Крутяков Е.Н. и др. Способ диагностики остеопороза методом определения динамики закрытия полостных образований для оценки эффективности применения различных остеопротекторов. Патент на изобретение №2511430. Приоритет с 19.04.2012.
Работа в журнале “Врач”, №6, 2014

