О. Джоунс, кандидат медицинских наук,
В. Струков, доктор медицинских наук, профессор,
А. Кислов, доктор медицинских наук, профессор,
Е. Еремина доктор медицинских наук, профессор,
М. Кондраченко доктор медицинских наук, профессор,
Т. Купцова
Медицинский центр Менсфилда, Fort Worth, США
Пензенский институт усовершенствования врачей
Врач № 10, 2017
Резюме: Представлены данные по оптимизации диагностики и лечения коморбидного остеопороза у пожилых. Коморбидность с увеличением возраста пациентов нарастает и отягощает клинику остеопороза. Показана необходимость учета коморбидных состояний, что позволяет улучшить персонифицированный подход и эффективность лечения. На примере 2 равноценных групп сравнивается два подхода в терапии коморбидного остеопороза: традиционный методов лечения антирезорбентами (заморозка остеокластов) и нового подхода – на поддержку анаболиками функции остеобластов. Показано преимущество анаболических свойств гормонов трутневого расплода в лечении коморбидного остеопороза. «Остеомед Форте» за 10-месяцев лечения остеопороза, дал хороший лечебный эффект, не оказывает никаких серьезных побочных эффектов как на остеопороз, так и на коморбидные заболевания. Путем улучшения гормонального (андрогенного) статуса пациенток в постменопаузе можно не только приостановить, но и добиться обратного развития болезни.
Ключевые слова: коморбидный остеопороз, полостные образования, перелом, минеральная плотность костей, «Остеомед Форте», денситометрия, TBS – шкала.
Содержание
Komorbidny osteoporosis
Challenges and new opportunities in its diagnosis and treatment
Summary: The data on the optimization of diagnosis and treatment of comorbid osteoporosis in the elderly. Comorbidity with increasing age of patients increases and aggravates osteoporosis clinic. The necessity of taking into account comorbid conditions, which improves a personalized approach and the effectiveness of treatment. In Example 2 equal groups compared two approaches in the treatment of comorbid osteoporosis: traditional therapies antirezorbentami (freezing osteoclasts) and a new approach – to support the anabolic osteoblast function. The advantage of the anabolic properties of hormones drone brood in the treatment of comorbid osteoporosis. “Osteomed Forte” for 10 months of treatment of osteoporosis, gave a good therapeutic effect, does not have any serious side effects such as osteoporosis, and for comorbid disease. By improving hormone (androgen) patients status in postmenopausal women can not only halt, but also to achieve the return of the disease.
Keywords: Comorbidity osteoporosis, cavity formation, fracture, bone mineral density, “Osteomed Forte”, densitometry, TBS – scale.
Остеопороз это прогрессирующее системное метаболическое заболевание скелета, которое характеризуется снижением массы кости, нарушением микроархитектоники костной ткани, что приводит к увеличению хрупкости кости и переломам после минимальной травмы (нетравматические) позвоночника, дистального отдела лучевой кости и проксимального отдела бедренной кости (перелом шейки бедра) [ 4,5,9,17].
Выделяют две формы остеопороза: первичный и вторичный. В свою очередь первичный остеопороз условно подразделяется на постменопаузальный и сенильный. Первичный остеопороз (ОП) может развиваться у мужчин и женщин в любом возрасте, чаще у женщин в период менопаузы и у мужчин в пожилом возрасте. Вторичный остеопороз является осложнением различных заболеваний (эндокринных, воспалительных, гематологических, гастроэнтерологических и др.) или лекарственной терапии (например, глюкокортикоидный остеопороз). По некоторым оценкам, вторичный остеопороз составляет 60% от всех случаев остеопороза у мужчин (наиболее часто связан с гипогонадизмом, приемом глюкокортикоидов и алкоголизмом), и примерно половину от всех случаев остеопороза у женщин в перименопаузе (гипоэстрогенемия, применение глюкокортикоидов, тиреоидных гормонов и противосудорожных препаратов) [6,8,21-23].
Современная медицина добилась больших успехов в диагностике, лечении и профилактике остеопороза, однако, несмотря на это его актуальность постоянно возрастает. Это связано с тем, что средняя продолжительность жизни практически во всех странах мира неуклонно растет. Старение – главный убийца, ежедневно в мире умирает 100 000 человек. Старение и остеопороз тесно связаны. Чем больше возраст, тем чаще остеопороз и чаще переломы. Старение населения планеты оказывает огромное влияние на живущих людей, на структуру заболеваемости и смертности. В частности, доля дегенеративных заболеваний опорно-двигательного аппарата, к которым относится остеопороз, значительно увеличивается. Известно, что после 50 лет каждая 3-я женщина страдает остеопорозом. Более трети женщин старше 65 лет имеют переломы тел позвонков, до 20-36% больных с переломом шейки бедренной кости погибают в течении первого года, и более 50% выживших становятся инвалидами [13, 14].
Сегодня много говорится о персонифицированном подходе в терапии остеопороза на основе молекулярно-генетических особенностей организма. Однако, чтобы реально внедрить персонифицированный подход в практическое здравоохранение необходимо сделать еще много. В частности внедрить более широкое использование вычислительной техники для анализа и моделирования молекулярно биологических систем для хранения любой биомедицинской информации, дальнейшее совершенствование клинико-лабораторных исследований и их доступность для каждого пациента и т.д. Но пока эти проблемы не решены или не доступны. Все это объясняет причину того, почему сегодня практикующему врачу нередко трудно добиться успеха или невозможно без учета роли очень многих сопутствующих и предрасполагающих факторов: возраст, неправильное питание, нет зубов, нарушение функции ЖКТ, что приводит к снижению переносимости молочных продуктов, уменьшению всасывания кальция. Нарушение гормонального статуса, недостаточное пребывание на солнце, что приводит к дефициту витамина D, гипокальциемии и т.д. В этих условия поддержание нормального уровня кальция в крови возможно только за счет усиленной резорбции костной ткани, что и ведет к остеопорозу и переломам. Такая ситуация указывает на острую необходимость разработки новых подходов в терапии и профилактике остеопороза.
Для персонифицированного подхода в лечении остеопороза в первую очередь необходимо улучшение диагностики ОП. Сегодня золотым стандартом в диагностике остеопороза является двухфотонная рентгеновская абсорбциометрия с определением минеральной плотности кости (МПК). Однако только по уменьшении МПК не всегда можно правильно верифицировать диагноз и тем более дать объективную оценку эффективности препарата в лечении остеопороза. Поэтому за последние годы большее внимание уделяется оценке состояния трабекулярной костной ткани, в которой метаболические процессы происходят в 8 раз активнее (по сравнению с кортикальной). Тем самым при оценке микроархитектуры трабекулярной кости повышается точность диагностики остеопороза и риска переломов. Ряд исследователей указывают на необходимость пересмотра классификации остеопороза по ВОЗ и учитывать не только МПК, но и микроархитектонику. Обоснованием является тот факт, что в настоящее время на фоне массового применения остеопротекторов, переломы нередко происходят при небольшом снижении МПК. Так в 70 лет средняя МПК равна – 2,5 СО и этот показатель не всегда отражает реальный риск перелома [14].
Наши исследования показали, что более точно определить качество кости и степень тяжести ОП и эффективность препарата можно только с учетом морфометрических данных [2, 11,12]. Без этого диагноз заболевания и эффективность препарата определить затруднительно или ошибочно, например при атипичном остеопорозе. Поэтому для оценки показателя качества трабекулярной костной ткани у таких пациентов нами предложена шкала TBS для костей предплечья [2]. Такое исследование проводятся на «Остеометрах» DTX-100 или DTX-200, что доступнее и дешевле, чем TBS для тел позвонков. Необходимость такой разработки была вызвана трудностями определения эффективности препарата для лечения остеопороза по одному количественному показателю МПК.
Человеческий организм – единое целое, где каждый орган, каждая клеточка тесно связаны между собой. Только слаженная и согласованная работа всех органов и систем позволяет поддерживать гомеостаз (постоянство) внутренней среды организма человека, необходимый для его нормальной жизнедеятельности. Однако на практике мы не всегда учитываем это, лечим не больного, а диагнозы [16-20]. Поэтому улучшение персонифицированного подхода – это в первую очередь улучшение коморбидной диагностики остеопороза, поскольку он, как правило, сочетается с другими серьезными заболевания сердца, суставов, сосудов, эндокринными болезнями¸ артериальной гипертензией и др. Часто такие пациенты лечатся у нескольких врачей, получают массу препаратов. Это нередко приводит к ятрогенной патологи, к появлению особых, ранее не встречаемой, трудно лечимой или не излечимой патологии.
Понятие коморбидности впервые было предложено в 1970 году американским врачом-эпидемиологом Алваном Фенштейном. Под коморбидностью он понимал одновременное протекание двух и более заболеваний или синдромов, которые патогенетически взаимосвязаны между собой. В переводе с латинского языка слово коморбидность состоит из 2 частей: co – вместе, и morbus – болезнь. Вскоре явления коморбидности привлекло внимание исследователей всего мира. Со временем термину «коморбидность» появилось немало синонимов: «полипатия», «полиморбидность», «мультиморбидность», «плюрипатология» и другие, но суть оставалась прежней. Позднее предложена классификация коморбидных состояний с выделением:
- Причинной коморбидности, обусловленной параллельным повреждением органов и систем, вызванных единым патологическим фактором. Примером такой коморбидности может служить поражение внутренних органов при терапии глюкокортикоидами.
- Осложненная коморбидность, как результат основного заболевания, например диабетическая нефропатия при сахарном диабете 2-го типа, инсульт вследствие гипертонического криза при артериальной гипертензии и др.
- Ятрогенная коморбидность – примером такого вида коморбидности является остеопороз, который развивается вследствие применения гормональных препаратов (глюкокортикостероидов). Подобная коморбидность также может развиться при химиотерапии, которая может стать причиной развития гепатита у больного.
- Неуточненная коморбидность – когда предполагается наличие единых механизмов развития болезней, составляющих общую клиническую картину, но для их подтверждения требуется проведение определенных исследований.
- «Случайная» коморбидность, например сочетание у больного ОП и камней в желчном пузыре (желчнокаменная болезнь).
Число коморбидных заболеваний у пациента напрямую зависит от возраста пациента: в детском возрасте сочетание заболеваний встречаются реже, однако чем старше человек, тем чаще вероятность развития коморбидных патологий. В возрасте до 19 лет коморбидные заболевания встречаются лишь в 10% случаев, к 80 годам этот показатель достигает 80% Если рассматривать данные патологоанатомических исследований умерших от терапевтической патологии в возрастной категории 67–77 лет, то коморбидность составляет около 95%. Более часто встречается коморбидность в виде сочетания двух-трех заболеваний, но бывают случаи, когда у одного больного имеет место сочетание до 6–8 заболеваний (в 2–3% случаев) [4] .
С коморбидностью сталкиваются практически все врачи. Однако узкие специалисты зачастую «закрывают глаза» на явление коморбидности, предпочитая заниматься лечением только «своего» – профильного заболеваниия, например остеопороза. А другие болезни оставляют своим коллегам. При таком подходе неизбежны ошибки, как в диагностике, так и в терапии ОП. Поэтому при наличии коморбидности для постановки правильного диагноза необходимо разобраться и просчитать рейтинг каждой болезни и ее роль в патологии. В диагнозе необходимо выделить основное заболевание, фоновые заболевания, осложнения и сопутствующие патологии. То есть среди «букета» заболеваний необходимо прежде всего определить ту болезнь, которая требует первоочередного лечения, так как она угрожает жизни пациента, снижает его трудоспособность, или же может спровоцировать опасные осложнения
При наличии фоновых патологий, последние осложняют течение ОП, усугубляют ситуацию, делают ее более опасной для здоровья и жизни пациента, способствуют развитию различных осложнений. Фоновое заболевание, как и основное, требует обязательной терапии. ОП как основное заболевание (нозологическая единица) ставится в тех случаях, когда он угрожает здоровью и жизни больного. Осложнения ОП как основного заболевания связаны с ним по патогенезу (например, перелом шейки бедра) могут привести к инвалидности или смерти больного. Таким образом, коморбидность ОП (как и любого другого заболевания), – негативный фактор для прогноза, так как, увеличивает сроки лечения больного, повышает количество осложнений, инвалидизацию, замедляют реабилитацию больного, повышает вероятность летального исход.
Поэтому задача каждого врача – видеть клиническую картину в целом, что называется, «лечить не болезнь, а самого пациента». При таком подходе снижается вероятность тяжелых побочных эффектов при выборе фармпрепаратов: врач может и должен учитывать их сочетаемость при одновременном лечение сразу нескольких патологий, всегда помнить изречение Е.М. Тареева: «Каждое непоказанное лекарство противопоказано».
Ряд исследователей полагают, что решение проблем лечения коморбидной патологии в изучении ОП лежит через изучение состояния репродуктивно восстановительной системы организма больного, роли гипотоламо-гипофизарно-репродуктивной системы при коморбидной патологии. Хадарцев А.А. и соавт. (2004) рассматривают проблемы восстановительного лечения остеопороза с позиции науки синергетики (от греч. synergetikos – согласованно действующий). Она устанавливает связи между элементами структуры (в данном случае коморбидных болезней пациента). Важно понимание согласованности взаимодействия частей коморбидной системы при образовании структуры, как единого целого. Эти положения разработанны школой П.К. Анохиным (1962), установившим, что определяющие поведение коморбидной системы, является многомерным, хаотическим к которому стремится биологическая динамическая система, осуществляя свою самоорганизацию коморбидных состояний. Проще говоря в коморбдном пациенте на основе определения всех коморбидных болезней всегда можно определить суммарный вектор ассоциированных болезней и его направление [1, 3, 7, 10].
Исследованиями установлено существование синергично работающих систем управляющих организмом человека на протяжении всей жизни. Кроме известной по Г.Селье гипоталамо-гипофизарно-надпочечниковой системы, выявлен ее антагонист гипоталамо-гипофизарно-репродуктивная система. Доказана их синергичная работа.
Выявление процессов самоорганизации позволит понять механизмы связи остеопороза (ОП) и коморбидной патологии. Однако здесь не все так просто! Наука не стоит на месте, она открывает новые и новые формы самоорганизации, что иногда радикально меняет наши представления о центральных механизмах развития болезней. Так за последние годы в системе самоорганизации костной структуры между остеокластом (ОК) и остеобластом (ОБ) выявлены сложные сигнальные связи. При этом для улучшения функции ОБ необходима повышенная активность ОК, это повышает активность ОБ и улучшает процессы ремоделирования костей. Открытие этой самоорганизационной ремодулирующей системы привело к революционному пересмотру патогенетического подхода к лечению ОП. Сегодня важно понимание согласованности взаимодействия частей системы ОБ-ОК при образовании костной структуры, как единого целого!!!
Цели работы:
изучить коморбидный статус современного возрастного пациента с остеопорозом и на основании полученных данных улучшить его диагностику и патогенетическую терапию новыми препаратами группы “Остеомед”.
Материалы и методы исследования
Наше исследование является открытым, проспективным, рандомизированным. Оно проводилось в соответствии с «Правилами проведения качества клинических испытаний» (ОСТ №42 от 29.12.1998г.), приказом №103 от 24.03.2000 г. «О проведении клинических исследований». Исследование проводилось с 2006 по 2016 годы на базе центра остеопороза Пензенского института усовершенствования врачей г. Пензы.
Для изучения коморбидного статуса обследовано 1500 женщин в возрасте 45–88 лет. Критериями включения в исследование: женщины с коморбидным ОП (не менее 3 заболеваний), с минеральной плотностью костной ткани (МПК) менее -2,5 СО и наличием полостных образований в трабекулярных отделах костей. Определение МПК проводилось рентгенабсорбционным методом на аппарате «Остеометр DTX-100», позволяющим одновременно определять не только количественные параметры МПК, но и морфометрические (полости и избыточное отложение солей в мягких тканях). При необходимости МПК определяли на аппаратах DTX-200, Lunar Prodigy. Обследование включало объективный осмотр, общеклиническое лабораторное определение общего тестостерона. Гормональное исследование проводилось совершенствование иммунохеми-люминесцентным методом на аппарате Immulite 2000.
Из числа обследованных (1500 пациенток) выделена однородная группа больных для изучения эффективной и безопасной терапии коморбидного ОП, включающая 156 женщин с коморбидным индексом (КИ) более 3-4 ЕД., составивших основную группу. Возраст обследованного контингента женщин составил 59,0±1,84 года, (средняя длительность постменопаузы 10,3±1,67 года). Женщины основной группы в зависимости от проводимой терапии были разделены на две подгруппы сопоставимые по возрасту, тяжести заболевания и коморбидному фону. В 1 подгруппу 79 пациенток (контрольная) получали стандартную терапию различными антирезорбентами (один из бисфосфонатов типа фосамакс, акласта, кальцитонин, Бонвива, Бивалос и др.) плюс Са Дз Никомед. Во 2 подгруппу (сравнения ) – 77 женщин с однотипной патологией, но для лечения применялся препарат с анаболическим компонентом «Остеомед форте». Всем пациенткам до начала лечения и по завершению 9 месячного курсов лечения проводилось определение МПК рентгенабсорбционным методом и биохимические исследования. Все участники проведенного исследования подписали информированное согласие. Протокол исследования одобрен этическим комитетом «Пензенского института усовершенствования врачей».
Тяжесть остеопороза оценивали по классификации ВОЗ плюс по микроархитектонике, наличию полостей в трабекулярных отделах костей. Критериями оценки эффективности терапии были: способность препарата увеличивать МПК, закрывать или уменьшать размеры полостных образований в трабекулярных отделах костей, увеличение мышечной силы; снижение частоты падений; отсутствие новых переломов, повышение двигательной активности. По разработанной нами компьютерной программе (TBS – шкалы для костей предплечья) на языке программирования Delphi проводился численный анализ изображений. Для этих целей графическое изображение представляется в виде двумерного массива данных пикселей. Вычисление площади интересуемых цветовых зон или полостей, анализ их динамики осуществлялись путем подсчета количества соответствующих пикселей. При повторном исследовании, учитывая размер исходного графического изображения, вычислялась фактическая площадь зон поражения после проведенного лечения. [2]
Статистический анализ полученных данных выполнен с помощью пакета программ StatSoft для Windows XP. Количественные признаки описывали с помощью среднего показателя и среднеквадратического отклонения. Разница средних величин считалась достоверной при р<0,05. Для определения характера связи между изучаемыми параметрами применялся корреляционный анализ с вычислением коэффициента корреляции r и последующим установлением его значимости по критерию t Стьюдента, а также использовались коэффициенты линейной корреляции Пирсона, коэффициент ранговой корреляции Спирмена.
Результаты исследования и их обсуждение
Все пациенты направлены в “Центр остеопороза ПИУВа” с диагнозом ОП. Однако, при дополнительном сборе анамнеза, углубленном осмотре и анализе лабораторно-инструментальных исследований у большинства пациентов кроме ОП выявлены различные заболевания, что в литературе описано под названием «полипатия»: Ниже представлены основные коморбидные группы:
- У 74% пациенток выявлены нарушения в гормональном статусе, эндокринные болезни (сахарный диабет, ожирение, гипотиреоз, снижение андрогенов, эстрогенов и др.) в том числе у 27% избыточная масса или ожирение. Возрастные нарушения в гормональном статусе у пожилых характеризовались комплексом симптомов — эмоциональных, когнитивных, сексуальных, метаболических (снижение роста и МПК). Эти состояния являются важной причиной формирования вторичного остеопороза, что обязательно учитывалось при составлении плана индивидуального лечения ОП.
- У 73% выявлены проблемы здоровья ротовой полости все пациентки осмотрены на кафедре стоматологии ПИУВа (зав. кафедрой д.м.н. Н.В.Еремина). Выявлено, что неконтролируемый пародонтит характерен для женского пола, особенно во время периодов гормональных колебаний, в течение полового созревания, из-за использования противозачаточных пилюль, во время беременности. Менопауза как правило ухудшает состояния зубов и пародонта, что может привести не только к рецессии десен и потере зубов, но и причинно и патогенентически детерминированному остеопорозу, к его манифестации, ухудшающие всасывание Са. Результатами исследований было показана на необходимость особого подхода к лечению такого коморбидного ОП.
- В 67% случаев пациенты имели сердечно-сосудистые заболевания: атеросклероз, гипертоническую болезнь. Коронарный атеросклероз, АГ и ОП одни из самых частых коморбидных состояний в клинике внутренних болезней. У 9% в анамнезе был перенесенный ишемический инсульт. В крови пациентов с ОП обнаруживают нарушения системы гемостаза, а также, периваскулярной соединительной ткани, которые приводят к отсроченному нарушению микроциркуляции, развитию во внутренних органах склеротических изменений, метаболических нарушений и снижению их функциональных резервов, вплоть до формирования полиорганной недостаточности.
- У 53% обследованных пациентов отмечен недостаток витамина D (недостаточное пребывание на солнце у большинства)? что имеет важное патогенетическое значение в развитии заболевания.
- У 50% обследуемых кроме ОП имели различные функциональные и воспалительные заболевания ЖКТ (гастрит, дуоденит, панкреатит, патология печении желчевыводящих путей и др.). По литературным данным особенно большая частота ОП (100%) с воспалительными заболеваниями кишечника (ВЗК). Базисная терапия ВЗК (язвенного колита и болезни Крона) включает стероидные гормоны, чем и объясняется большая частота ОП. Однако ряд авторов предполагают, что остеопороз при болезни Крона представляет собой особое внекишечное заболевание, патогенез которого не изучен, так как нарушения минеральной плотности костной ткани часто выявляются у таких больных с впервые установленным диагнозом ВЗК, но не получавших гормоны. Возможно причинами остеопороза при ВЗК, кроме глюкокортикоидной терапии, могут служить аутоиммунный механизм развития остеопороза. В этом случае ОП следует рассматривать как внекишечное проявление ВЗК. К ОП предрасполагают и заболевания печени, вызывающие нарушение метаболизма витамина D и Са/фосфорного обмена. При аутоиммунном процессе к патогенетическим факторам присоединяется гиперпродукция интерлейкинов и провоспалительных цитокинов, приводящие к усилению резорбтивных процессов в кости (Турбина М.В., Белоусова Е.А., 2015).
Если сложить частоту коморбидных состояний в этих группах 74+73+67+53+50 = 317%. Это значит, что математическое ожидание по теории вероятности у вышеотмеченных условных 5 группах кроме ОП пациенты имели от 2 до 5 дополнительных коморбидных заболеваний! Больше 50% пациентов кроме ОП имели по 3-4 заболевания, т.е. индекс коморбидности (ИК) равен (3-4) + 1(ОП) = 4-5.
Но ИК в реальности значительно больше, если учесть, что в составе обследованных были пациенты и с другими диагнозами в т.ч. с ревматическими, гематологическими, онкологическими болезнями (у 9%). У 28% пациентов постменопаузальный ОП сочетался с остеоартрозом крупных и мелких суставов. Бронхиальная астма, прием глюкокортикоидов, болезни почек были у 12%. Все эти заболевания патогенетически связаны с развитием ОП. Так, например при заболевании почек, подключается почечное звено, заключающееся в гиперреактивности ренин-ангиотензин-альдостероновой системы, повышении активности юкстагломерулярного аппарата, гиперпродукции ренина и ангиотензина II, нарушении образования гормона D. При этом почечный механизм формирования ОП становится доминирующим. Индекс коморбидности у пациентов значительно увеличивается при подключении параклиничесих методов исследования. Так после лучевых исследований УЗИ, МРТ, КТ почти у всех пожилых пациентов выявляются снижение или ассиметрия мозгового кровотока, кальциноз аорты и кровеносных сосудов, наружной заместительной гидроцефалии, грыжи дисков позвоночника и т.д. Осмотр гинеколога, окулиста, невропатолога, психиатра и др. добавляет пациенту немало диагнозов. Поэтому при системном подходе у возрастного пациента нередко выявляются по 7-8 и более заболеваний.
С учетом изложенного имеющееся разнообразие патогенетических процессов, приводящих к развитию коморбидного первичного и вторичного ОП, диктует необходимость разработки персонифицированного, комплексного подхода к терапии таких пациентов. Общими задачами которого являются: регресс обратимых процессов, стабилизация необратимых изменений, восстановление или повышение утраченных и нарушенных функций, улучшение деятельности опорно-двигательного аппарата, нейро-эндокринной, сердечнососудистой, пищеварительной систем, нормализации психологического и социального статуса, повышение толерантности к физическим нагрузкам.
Сегодня разработать персонифицированный подход для лечения каждого пациента и создать для него индивидуальное лекарство задача невыполнимая, даже в будущем. Поэтому подбор индивидуальной терапии на данном этапе развитии науки возможен только на основе разумной патогенетической группировки различных коморбидных состояний в более крупные группы. Поэтому, нами на примере представленных 5 коморбидных групп пациентов продемонстрирован персонифицированный подход. У всех пациентов этих групп есть много общего: возраст, климакс, нарушение гормонального статуса, дефицит эстрогенов, андрогенов, дефицит витамина D и его активных метаболитов за счет болезней ЖКТ, печени, почек, нарушение продукции Са связывающих белков и ухудшения всасывания Са кишечнике и т.д. А следовательно, этим пациентам необходимо улучшить гормональный статус. Для этого хорошо подойдут гормоны (ГЗТ), но они дают массу осложнений в том числе онкологические. Поэтому лучше дать энтомологические гормоны (трутней), как субстрат для синтеза собственных гормонов. Хорошо поддержать организм пациента дополнительным введением витамина D, препаратов кальция. С учетом всего этого нами разработаны 3 препарата для улучшения персонифицированного подхода в терапии ОП: Остеомед, Остео-Вит, Остеомед Форте. В данной работе рассматривается «Остеомед Форте» (патенты № 2497533, 249881). Его состав: витамин D3 1,5 мг, трутневый расплод 50 мг, цитрат Са 250 мг, витамин В6 0,5 мг.
Необходимо отметить, что по мере увеличения продолжительности жизни возрастает не только коморбидность ОП. При этом растет частота и полипрагмазии, когда пациентам назначалось до 5-9 и более лекарств. В этих условиях можно причинить больному вред, вплоть до инвалидности и смерти. Важно выявить основную причину(ы) остеопороза в каждом конкретном случае , что не всегда легко. Так нами наблюдалась пациентка А., которая по поводу остеопороза получала без эффекта 9 препаратов в том числе 2 остеопротектора. Проведено дополнительные исследования, у пациентки выявлен основной диагноз – гипогонадизм, вторичный ОП, пересмотрена терапия с назначением ГЗТ, количество препаратов сокращено до 3. При этом состояние пациентки быстро улучшилось. Таких примеров можно привести много.
Т.о. выявление коморбидных заболеваний имеет важное значение для решения ряда совсем не легких проблем по диагностике и планированию ведения пациента, по выявлению основной причины ОП и выявлению роли коморбидных факторов. И только после диагностики коморбидных состояний, выявления этиопатогенетической причины остеопороза осуществлялся второй этап – персонифицирующий подход в лечении. Но для этого необходимо было разработать и создать специальную линейку отечественных препаратов, это «Остеомед», «Остео-Вит Dз», «Остеомед Форте» (планируется пополнение еще двумя препаратами).
При анализе материала выявлено, что в Пензе, как и в Поволжском регионе России лечащие врачи пытаются решить проблему остеопороза и переломов костей назначением небольшого числа одних и тех же импортных остеопротекторов. Они назначаются всем пациентам, нередко без учета возраста, коморбидных факторов и типа остеопороза. Поэтому у большинства таких пациентов отмечалась малая эффективность антирезорбентов. Такую же ситуация с малой эффективностью импортных остеопротекторов, отмечают И.В. Радионова и соавт, 2015 и др. [8]
При анализе лечения у наблюдаемых коморбидных пациентов отмечено, что у значительной части возрастных пациенток антирезорбенты были не только не эффективны, но и вызывали ухудшение. Например, при назначении их совместно с нестероидными противовоспалительными препаратами. Почти все такие пациенты отмечали дискомфорт в желудке, обострение или присоединение болезней ЖКТ (гастрит, язвенная болезнь). Такая же картина и малая эффективность отмечена при лечении ОП на фоне гастрита с пониженной кислотностью карбонат Са с витамином Dз. Са Dз Никомед хорош только для лечения изжоги! Низкая эффективность лечения ОП, и реакции со стороны ЖКТ также отмечены при использовании «Бивалос». На возможность негативного влияния антирезорбентов указывают многие источники. В частности поскольку нижняя челюсть является участком самого активного ремоделирования костной ткани, то при назначении бисфосфонатов описаны случаи некроза костей челюсти и перелом их, особенно при назначении более высоких доз. Атипичные переломы бедра также являются осложнениями длительной терапии бисфосфонатами.
Несмотря на эти недостатки современные рекомендации по-прежнему указывают, что препаратами выбора в лечении ОП у пожилых женщин по-прежнему являются бисфосфонаты (алендронат, этидронат, ризедронат), как наиболее мощные ингибиторы костной резорбции. При этом о коморбидности ОП ни слова! А как эти препараты действуют на стареющие клетки пожилого человека, если они убивают остеокласты? Они значительно повышают минеральную плотность за счет подавления функции остеобластов и уменьшение костной резорбции. Но сейчас, как уже указывалось выше, отношение к ним меняется в негативную сторону! Установлено, что между остеокластом (ОК) и остеобластом (ОБ) выявлены сложные сигнальные связи. При этом для улучшения функции ОБ необходима повышенная активность ОК, что улучшает нормальные процессы ремоделирования костей. Это привело к революционному пересмотру патогенетического подхода к лечению ОП. Мы полагаем «убивать», «цементировать», делать «заморзку» остеокластов у пожилых людей не гуманно. Наоборот, пожилому человеку необходимо дополнительная поддержка всем клеткам организма, костным, нервным, эндокринным, иммунным, ибо они работают вместе. Если ударить по ОК, то не могут эффективно работать ОБ, остеоциты и другие клетки, роль которых еще не изучена.
С учетом изложенного мы стремились не назначать антирезорбены, «убивающие», «цементирующие» остеокласты. Вместо них давали анаболики типа «Остеомед». При кальций дефицитных состояниях (недостаточное потребление молочных продуктов, хронические заболевания желудочно-кишечного тракта) назначался «Остеомед», содержащей цитрат кальция. При снижении в крови 25(ОН) D в сыворотке крови (дефиците витамина D) пациенту назначали «Остео-Вит Dз», при тяжелом остеопорозе I и II типа (при постменопаузальном и сенильном), при не травматичных переломах костей назначается «Остеомед Форте», по которому и проводился анализ.
Результаты исследования представлены в таблице 1. Из данных которой видно, что на фоне традиционной терапии и нового подхода в лечении ОП произошла нормализация показателей кальций-фосфорного обмена, в том числе и снижение в крови уровня таких маркеров резорбции кости как Са/кр, Р/кр. Об этом же свидетельствует возрастание кальцитонина в процессе терапии, что также является одним из факторов, способствующих снижению интенсивности костных потерь и нормализации костного ремоделирования у пациенток в постменопаузе.
Анализ динамики МПК в подгруппах выявил статистически значимый прирост МПК как на фоне стандартной терапии (3,7%), так и на фоне Остеомеда Форте (3,5%), что указывает на выраженный лечебный эффект обоих подходов терапии ОП (р>0,05).
Таблица 1
Динамика показателей МПК и некоторых биохимических маркеров костного метаболизма и морфометрии полостных образований в зависимости от проводимой терапии
| Маркеры | Исходные |
1 подгруппа |
2 подгруппа |
| Са2+ кр(ммоль/л) | 2,27±0,04 | 2,6±0,06 | 2,59±0,05 |
| Р (ммоль/л) | 1,65±0,03 | 1,74±0,05 | 1,71±0,04 |
| Тестостерон нмоль/л | 1,15 ±0,4 | 1,3± 06 нмоль/л | 2,4± 0,5 нмоль/л* |
| ГСПГ нмоль/л | 64,7±2,2 | 66,1±2,4 | 113±5,7* |
| 25(ОН)Dз нг/мл | 17±2,3 | 30±2,9 | 47±3,1 |
| ПТГ (pg/ml) | 50,12±1,97 | 47,1±2,1 | 46±2,4 |
| КЩФ (Ед/л) | |||
| КТ (пг/мл) | 3,0±0,08 | 4,5±0,93* | 4,9±0,91* |
| Прирост МПКТ % | 3,7 | 3,5 | |
| Закрытие полостей % | n – 2 (3±2%) | n – 20(26±5%)* | |
| Уменьшение полостей % | n-7 (9± 3) | n-38 (49±6%)* | |
| Отсутствие новых переломов, % | 100 | 100 |
*динамика от исходных и значений 1 группы статистически достоверна (р<0,05).
Однако при анализе показателей гормонального статуса у пациенток выявлено, что если концентрация общего тестостерона у женщин 1 подгруппы не достоверно увеличивалась с 1,15 ±0,4 нмоль/л до 1,3±0,6 нмоль/л (р>0,05), то во 2 подгруппе достоверно увеличивалась – с 1,15 ±0,4 нмоль/л до 2,4±0,5 нмоль/л (р<0,05). Концентрации ГСПГ до лечения составляла 64,7 ± 2,2 нмоль/л. Через 10 мес терапии антирезорбентами в 1 подгруппе незначительный рост до 66,1 ± 2,9 нмоль/л (р>0,05). При терапии «Остеомедом Форте» (2 подгруппа) через 10 месяцев отмечено достоверное увеличение до 113±5,7 нмоль/л (р<0,05).
Представлял интерес анализ 25(ОН)D основного метаболита в крови при ОП. Этот важный показатель отражает статус витамина D в организме и состояние метаболических процессов не только в костях, но и во всех системах организма. У большинства обследованных коморбидных пожилых пациентов имелся сниженный статус – недостаток витамина (M±m = 17±2,3 нг/мл). Через 10 мес. лечения в 1 подгруппе 25(ОН)D повысился до нижней границы нормы (M±m = 30±2,9 нг/мл). Во 2 подгруппе при терапии “Остеомедом Форте” содержание 25(ОН)D достоверно повысилось до средних нормативов – 47±3,1 нг/мл (р<0,05). Это можно объяснить составом препарата и тем, что гормоны трутней являются фортификатором (усилителем) метаболизма витамина D.
Проведен анализ влияния способов терапии в подгруппах на закрытие полостных образований по разработанной нами шкале ТВС (авторск свидетельство № 2013660284 от 10.09. 2013г.) по данным рентген абсорбционной остеометрии. При использовании “Остеомеда форте” (2 подгруппа) закрытие и уменьшение полостей отмечено у 75±6%, против 12±3% в 1 подгруппе (р<0,05). Эти данные свидетельствуют о том, что данный препарат более эффективно действует на трабекулярную часть кости, в которой главным образом образуются полостные образования, через которые и происходят переломы костей, это важно.
Клинический пример. Пациентка Р-ва 52 года, направлена в центр с типичным направительным диагнозом остеопороз. При сборе анамнеза и изучении медицинской документации выявлены заболевания: хронический пародонтит, хронический гастрит, гипертоническая болезнь. При рентгеновской остеоденситометрии МПК по Т шкале – 3,5 СО, при морфометрии с использованием ТВС шкалы в трабекулярных отделах костей определяются полостные образования. 25(ОН)D нг/мл. Выставлен основной диагноз: постменопаузальный ОП с полостными образованиями, переломом костей предплечий в анамнезе, риск повторных костных переломов. Фоновые заболевания: хронический пародонтит, хронический гастрит, недостаток витамина D. Сопутствующее заболевание – гипертоническая болезнь. Назначено комплексное лечение с учетом коморбидности:
- Рациональное питание по остеопорозу и гастриту с включением кисломолочных продуктов, творога и сыра.
- “Остеомед Форте” по 2 таблетки 2 раза в день на 3 мес.
- Лечение хронического парадонтита у стоматолога.
- Антигипертензионный препарат.
- Не медикаментозное лечение (скандинавская ходьба, ЛФК, образовательная программа). Итого всего 3 препарата для профилактики полипрагмазии.
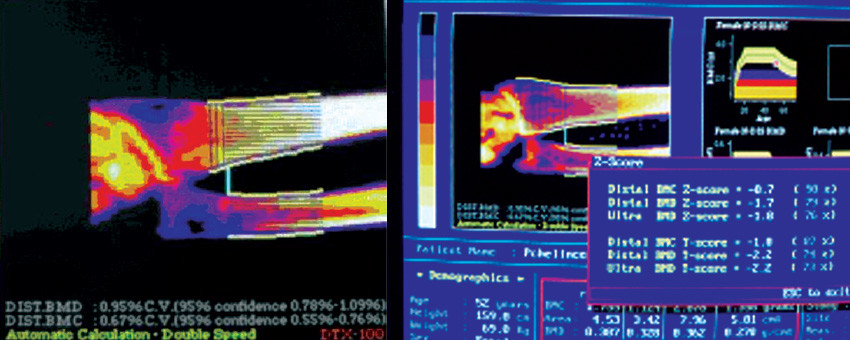
Рис.1.Пациентка Р. 52 года, протокол обследования №2197
а – полостные образования до лечения; б – через 10 месяцев терапии полостей нет
После проведения полного курса лечения (три трехмесячных курса с 1 мес. перерывами) состояние пациентки значительно улучшилось. МПК увеличилась до -2,2СО, а полостные образования закрылись (см. рис.1).
При терапии “Остеомед Форте” нами не были установлены негативные клинические и костно-метаболические изменения, свидетельствующие о прогрессировании ОП. Имеющие место остеопоротические нарушения не прогрессировали, наступало улучшение или стабилизация процессов.
Таким образом предложенные способы диагностики остеопороза, с учетом коморбидной патологии у пациентов позволяет значительно улучшить персонифицированный подход в терапии ОП, повысить эффективность терапии. Применение новых патогенетических препаратов с анаболическим эффектом типа “Остеомед Форте” содействует улучшению процессов ремоделирования в костях, что позволит не только повысить эффективность терапии остеопороза у пенсионеров, но и добиться стабилизации и даже обратного развития процесса. В то время, как при стандартных подходах терапии остеопороза, когда одно и то же лекарство рекомендуется пациентам «Всея России» без учета коморбидности, не всегда эффективно, но обеспечивает максимальный вывоз капитала за рубеж и экономические проблемы в нашей стране.
На основе полученных результатов считаем, что высокий лечебный эффект препарата «Остеомед Форте» в лечении коморбидного остеопороза обусловлен содержанием в нем трутневого расплода. Последний как донатор андрогенов стимулирует продукцию собственных половых гормонов у пациенток, что улучшает анаболические процессы и костное ремоделирование. Это содействует стабилизации патологии, приостановлению костных потерь и увеличению МПК физиологическим методом, без депрессии остеокластов. Это подтверждается тем, что у женщин с постменопаузальным остеопорозом после курса терапии концентрация общего тестостерона в сыворотке крови повышалась с 1,15±0,4 до 2,4±0,5 нмоль/л (р<0,05). В подгруппе пациенток, получавших антирезорбентные препараты, положительных сдвигов в уровне тестостерона не отмечалось.
Выводы:
- Диагностика остеопороза у пожилых людей требует особых подходов и использовать не только определение минеральной плотности костей, но и новые технологии с использованием компьютерных программ типа TBS. Определение МПК в сочетании с морфометрией в динамике позволяет не только улучшить диагностику остеопороза, но и индивидуальный подбор более эффективного препарата для его лечения.
- Диагностика ОП с учетом коморбидности этой патологии позволяет более детально верифицировать диагноз заболевания с учетом всех факторов риска. Это позволяет проводить рациональную группировку пациентов с близкими патогенетическими процессами и максимально индивидуализировать терапию пациентов, избегая полипрагмазии.
- В современной терапии ОП важно использовать новые патогенетические подходы направленные на устранение дисбаланса остеокласт – остеобласт, анаболической поддержкой остеобластов с помощью остеопротекторов с содержанием трутневого расплода. Путем улучшения гормонального (андрогенного) статуса пациенток в постменопаузе можно не только приостановить, но и добиться обратного развития болезни.
- «Остеомед Форте» не вызывал никаких серьезных побочных эффектов на коморбидный остеопороз и коморбидные заболевания. Напротив при ряде сопутствующих заболеваний отмечен положительный эффект, например при артропатиях, артритах мелких и крупных суставов, недостаточности витамина D и др. «Остеомед Форте» может служить стартовым или препаратом выбора для лечения остеопенических проявлений у большинства пациентов с коморбидной патологией.
- В отличии от других лекарств, препараты группы «Остеомед» можно дифференцированно использовать с учетом МПК и тяжести остеопороза. В тех случаях когда у пациента имеются выраженная потеря МПК и полостные образования в костях с риском костных переломов показан «Остеомед Форте». При избыточном отложении солей Са в мягкие ткани и сосуды, при экзогенной/эндогенной недостаточности витамина D хорошо дать «Остео-Вит Dз» (без кальция). При остеопениях (не больших потерях костной массы и гипокальциемии дать “Остеомед”.
- «Остеомед Форте» отвечает всем требованиям по импортозамещению. Внедрением его в практическое здравоохранение России для лечения остеопороза можно значительно уменьшить импортозависимость и вывоз капитала за рубеж.
Список используемой литературы:
- Анохин П.К. Опережающее отражение действительности // Вопр. философии. 1962, №7. С. 97-111.
- Бойков И.В., Струков В.И., Семерич Ю.С. Программа определения степени поражения пациента остеопорозом. Свидетельство о государственной регистрации программы для ЭВМ № 2013660284 от 10.09. 2013г.
- Герасимов И.Г. Энтропия биологических систем // Проблемы старения и долголетия. 1998. Т.8, №2.C.39-44.
- Иноземцев О.Н. Казахская медицинская научно-популярная газета Эксперт здоровья». 21-10-2014.
- Исмаилова О., Еремина Н.,Струков В. и соавт. Лечение хронического пародонтита у женщин в постменопаузальном периоде с учетом минеральной плотности костной ткани.//Врач.2015,10.С.
- Козырев К.М., Тутаева З. Р. Патогенез и клиникоморфологические особенности нейродегенеративных заболеваний у долгожителей различных климатических районов Северного Кавказа // Вестник новых медицинских технологий. Тула, 2005. T.XII, № 3-4. С.120-124.
- Пригожин Й.Р., Стингерс И. Порядок из хаоса: новый диалог человека с природой. М.: Прогресс, 1986.
- Радионова И.В., Скворцов В.В., Скворцова Е.М., О.В. Разваляева. Системный остеопороз и остеопороз нижней челюсти. Медицинская сестра, 2015, №5
- Руководство по геронтологии под ред. В.Н. Шабалина, М. 2005, с. 800
- Селье Г. Очерки об адаптационном синдроме. М.: Медгиз, 1960. 254 с. 20. 248 с.
- Джоунс О.В. Способ и препарат для профилактики и лечения атипичного остеопороза с нормальной или повышенной минерализацией костной ткани с наличием полостных образований в трабекулярных отделах костей. Патент на изобретение №2497533.
- Джоунс О.В. Способ профилактики и лечения остеопороза и переломов костей и препарат для профилактики и лечения остеопороза и переломов костей. Патент на изобретение №2498811. Приоритет изобретения от 19.04.2012 г.
- Джоунс О.В Способ диагностики остеопороза методом определения динамики закрытия полостных образований для оценки эффективности применения различных остеопротекторов. Патент на изобретение №2511430. Приоритет с 19.04.2012 г.
- Струков В.И., Катюшина Ю.Г., Филиппова О.В. Остеомед – эффективный регулятор минеральной плотности костей и закрытия полостных образований при лечении пресенильного и сенильного остеопороза // Поликлиника. – 2013; 1 (1): 90-1.
- Хадарцев А.А., Тутельян В.А., Зилов В.Г, и др. Теория и практика восстановительной медицины: Монография. Под ред. B. А. Тутельяна. М.: Российская академия медицинеких наук. Тула: Тульекий полиграфист. 2004. Т.1. 8.Bruyere O. et al. Strontion Ranelateon spinal osteoarthritis progression // An- nual Rheumatology Disorder. – 2008. –Vol.67: 335–339.
- Kalinchenko S., Vishnevskiy E. L., Koval A. N., Mskhalaya G. J., Saad F. Beneficial effects of testosterone administration on symptoms of the lower urinary tract in men with late-onset hypogonadism: A pilot study // The Aging Male. – 2008. – Vol. 11; 2: 57–61.
- National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Washington, DC: National Osteoporosis Foundation; 2014.
- Durie B.G., Katz M. Croweiy J. Osteonecrosis of the jaw and bifоsfonates. N Engl J Med 2005 N21, p.99 – 102. L., Koval A. N., Mskhalaya G. J., Saad F. Beneficial effects of testosterone administration on symptoms of the lower urinary tract in men with late-onset hypogonadism: A pilot study // The Aging Male. – 2008. – Vol. 11; 2: 57–61.
- Murad OM, Arora S, Farag AF, Guber HA. Bisphosphonates and osteonecrosis of the jaw: a retrospective study. Endocr Pract. 2007 May-Jun;13(3):232-8.
- Montebugnoli L, Felicetti L, Gissi DB, Pizzigallo A, Pelliccioni GA, Marchetti C. Biphosphonate-associated osteonecrosis can be controlled by nonsurgical management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007 Oct; vol.104, N 4 p.473-7.
- Gunther C. et al. Beneficial Effect of PTH on Spine BMD and Microarchitecture (TBS) Parameters in Postmenopausal Women with Osteoporosis. A 2-Year Study. Osteoporosis Int., (2012) 23(2): S.85–386.
- Hans D. et al. Beneficial Effects of Strontium Ranelate Compared to Alendronate on TBS Menopausal Osteoporotic Women.A 2-Year Study. Osteoporosis Int., (2012) 23(2): 85–386.
- Leslie W.D., Kanis J. Lumbar spine TBS is a FRAX independent risk factor for fracture. The Manitoba BMD Cohort. ISCD Annual meeting 2013. Tampa, Florida.
- Беляева Е. А., Хадарцев А. А. Теоретические аспекты восстановительного лечения остеопороза при коморбидной патологии // ВНМТ. 2010. №3. URL: (дата обращения: 07.12.2016).
Коморбидный остеопороз: проблемы и новые возможности в диагностики







