Среди кожных болезней особое место занимает псориатическая артропатия, поскольку при ней одновременно страдает эпидермис и суставы. Зачастую происходит нарушение кальциевого обмена. Все это значительно ухудшает качество жизни пациента, негативно влияет на семейный бюджет. Поэтому изучение данного заболевания актуально. Необходимо проводить исследование новых препаратов, которые могут облегчить заболевание. Представляем статью доктора медицинских наук И. Сарвилиной «Молекулярные механизмы эффективности препарата «Остеомед Форте» при псориатической артропатии». В этой публикации приводятся интересные сведения. Например, в США этим заболеванием страдает один миллион человек. Там ежегодно на ее лечение выделяется миллиарды долларов, но успехов в лечении пока мало.
Замечено, что если болезнь возникает у молодых мужчин, то вылечить ее будет достаточно трудно. Причины возникновения псориатической артропатии до конца не выяснены. Многие специалисты уверены, что речь идет о совокупности разных факторов: генетических, иммунологических и воздействии внешней среды. Среди главных причин расстройства называют нарушение кальциевого обмена, а провоцируют ее различные инфекции. У таких больных происходит отложение иммуноглобулинов в эпидермисе, выявляются антитела к компонентам кожи, ухудшается работа Т-лимфоцитов.
Автор статьи отмечает, что необходимо разрабатывать лекарства, которые регулируют нейроиммуноэндокринные взаимодействия при этом недуге. Также полезно проводить исследование новых препаратов, которые уже вышли на рынок. Ряд из них позволяет предотвратить нарушение кальциевого обмена в организме.
Исследовательница предлагает использовать для терапии заболевания биологически активные добавки. В частности, она решила изучить молекулярную активность препарата «Остеомед Форте». Эта добавка содержит такой сильный компонент как трутневый гомогенат, благодаря чему может поддерживать уровень гормонов в организме. Кроме того включает цитрат кальция, витамин D3, а также витамин В6, который улучшает работу кишечника. Благодаря этому значительно активизируется всасывание кальция в организм.
Всего в исследовании принимали участие 60 больных псориатической артропатией: мужчины и женщины старше 18 лет. Их разделили на три группы по 20 человек. В первой больные месяц принимали мелоксикам, кальципотриол/бетаметазон (наружно). Во второй группе кроме этих лекарств давали еще препарат «Остеомед Форте». Оставшиеся пациенты вошли в контрольную группу, которая не принимала лекарств. Вторая группа после основного лечебного курса продолжала употреблять «Остеомед Форте». Всего эксперимент продолжался в течение полугода. При этом использовались физикальные, инструментальные, лабораторные методы исследования. Проводились: магнитно-резонансная томография суставов, рентгенография, ЭКГ, эхокардиография, УЗИ внутренних органов, общеклинический анализ крови. Также анализировались амбулаторные карты пациентов.
В ходе эксперимента было доказано, что «Остеомед Форте» благотворно действует на состояние больных. Отмечалась положительная динамика излечения от псориазной артропатии. Происходило облегчение суставных болей, уменьшились последствия нарушения кальциевого обмена. Исследовано воздействие нового препарата на молекулярном уровне. Он позволяет замедлять прогрессирование данного заболевания, хорошо переносится пациентами.
Журнал «Врач», № 5, 2016 год.
Автор: д.м.н. И. Сарвилина МЦ «Новомедицина», Ростов-на-Дону.
«Молекулярные механизмы эффективности препарата «Остеомед Форте»
при псориатической артропатии»
Содержание
Молекулярные механизмы эффективности
препарата «Остеомед Форте» при псориатической артропатии
Введение
Распространенность псориаза в мире составляет от 1 до 3%. Псориазом поражено 4,5 млн. жителей США (2,1%) и еще 1 млн. жителей страдает псориатической артропатией (ПА) (0,5%). Распространенность псориаза минимальна у китайцев (0,4%), в Западной Африке (0,3-0,7%) и у афроамериканцев (0,7%). У японцев и индийцев распространенность заболевания составляет 0,3-1% и 0,8 % соответственно, в кавказской популяции варьирует от 1% до 5% (Farber, Nall, 1991), в Австралии приближается к 2,5% (Duffy, 1993). В странах Западной Европы этот показатель распределился следующим образом: 3% в Дании (Brandrup, Green, 1981), 4,8 % в Норвегии (Kavli, 1985). В России распространенность псориаза достигла 217,4 на 100 000 населения, ПА – 12,3 на 100 000 населения, что составляет 5,7% от всех случаев псориаза (взрослые – 5,5%; дети – 0,2%). Заболеваемость ПА в России – 1,8 на 100 000 населения (0,3 у детей и 2,1 у взрослых на 100 000 населения) [2].
Наблюдается бимодальное распределение распространенности заболевания в зависимости от возраста: первый пик заболеваемости приходится на возраст 15-35 лет, второй – на 57-60 лет, у детей-в возрасте 10 лет [6]. У женщин средний возраст возникновения заболевания ниже, чем у мужчин. Псориаз ухудшает качество жизни (КЖ) человека, что может сравниться со снижением КЖ при гипертензии, сахарном диабете, депрессии. Ежегодные расходы на лечение псориаза в США составляют 3 млрд. долл.¸ но эти затраты не могут улучшить КЖ пациентов. В исследовании Feldmann с соавт., у 578 пациентов с псориазом показано, что ежегодные затраты на ведение 1 пациента составляют 800 долл.[5]. Данные Ellis и соавт. включали группу пациентов, получавших терапию этретинатом, затраты на которую составили 2300 долл. в год по сравнению с другими видами лечения псориаза, затраты на которые составили 10000 долл. в год [4].
Наиболее частым осложнением псориаза является ПА в возрасте от 30 до 50 лет. ПА характеризуется сочетанным поражением суставов конечностей и позвоночника, относится к серонегативным артритам. Предикторами неблагоприятного течения ПА являются молодой возраст и мужской пол. Развитие ПА обусловлено взаимодействием генетических, иммунологических факторов и факторов внешней среды. Иммунологическая составляющая патогенеза проявляется обнаружением клеточных инфильтратов в коже и ткани суставов, высокой экспрессией иммуноглобулинов в эпидермисе и синовиальной мембране. В сыворотке крови регистрируется повышение иммуноглобулинов класса А (у 90%) и G, циркулирующих иммунных комплексов, антител к компонентам кожи и антинуклеарных антител, снижение ответа Т-лимфоцитов, уменьшение супрессорной клеточной функции, экспрессия фактора некроза опухоли-aльфа. Триггерными факторами развития ПА являются бактериальная, вирусная и другие виды инфекции [1]. В патогенезе ПА ключевую роль играет нарушение кальциевого обмена. Перераспределение кальция приводит к перестройке нейроиммуноэндокринной регуляции и нарушению функций на субклеточном, клеточном, тканевом, органном и системном уровнях, в т.ч., в коже и суставах.
Данные клинических исследований позволяют рекомендовать для лечения обострения хронического псориаза и ПА циклоспорин, системные ретиноиды (ацитретин, этретинат), комбинацию топического витамина D3 (кальципотриол, такальцитол) с топическими стероидами, фумараты, НПВС. Неубедительными являются данные, касающиеся применения метотрексата, гидреа, азатиоприна, сульфосалазина, хондропротекторов [3]. Новые терапевтические агенты характеризуются специфическим воздействием на молекулы-мишени, определяющие патофизиологические процессы при псориазе (alefacept, efalizumab, etanercept, infliximab, adalimumab) [7,8]. Отсутствуют новые лекарства, регулирующие нейроиммуноэндокринные взаимодействия при ПА, посредством влияния на кальциевый обмен и связанные с ним молекулярные патологические пути. Одним из важных этапов создания оригинальных лекарств является разработка, внедрение и анализ механизмов эффективности биологически активных добавок как источников новых молекул для разработки эффективных средств терапии ПА.
Целью работы явилось исследование молекулярных механизмов эффективности препарата «Остеомед форте» (цитрат кальция, биологически активная добавка «Гомогенат трутневый с витамином В6», пиридоксина гидрохлорид [витамин В6], витамин D3; вспомогательные вещества: лактоза, кальция стеарат, ООО «Парафарм», Россия) при ПА.
Материал и методы исследования
Исследование являлось пострегистрационным проспективным с параллельным дизайном и проводилось в соответствии с «Правилами проведения качественных клинических испытаний (GCP)» (ОСТ №42-511-99 от 29.12.98 г.), принципами Декларации Хельсинки /Токио /Венеция /Гонконг /Вашингтон /Эдинбург /Сеул (1964-2008 гг.).
Критерии включения в исследование: 1. Диагноз ПА в соответствии с CASPAR (ClASsification criteria for Psoriatic ARthritis, 2006) и модифицированными критериями Bennet et al. 2. Мужчины и женщины от 18 до 70 лет включительно. 3. Не менее 5 болезненных и 5 припухших суставов. 4. Стабильная доза НПВС и топических глюкокортикостероидов на протяжении всего исследования и за 28 дней до начала лечения. 5. Отсутствие базисной терапии в течение 28 дней до начала лечения. 6. Добровольное информированное согласие. Критериями исключения из исследования являлись: атипичные формы или прогрессирующее течение вульгарного псориаза; отказ пациента от участия в программе клинического исследования, повышенная чувствительность к компонентам препарата «Остеомед форте»; беременность, кормление грудью; тяжелые соматические заболевания, влияющие на течение ПА и иммунный статус пациента; прием иммуномодуляторов и системных противовирусных средств, препаратов кальция, витамина D3 и В6 менее чем за 3 месяца до момента включения в программу или во время участия в программе; наличие на момент включения в программу любого острого инфекционного заболевания; нарушение функции печени или почек, нарушение функции кроветворения на скрининговом визите; наличие других артритов и артропатий; алкоголизм, наркомания; сопутствующая онкологическая патология.
В исследование было включено («0» день) 60 пациентов с диагнозом «Псориатическая артропатия» (М07, М07.00, М07.01, М07.3) в возрасте старше 18 лет согласно клинико – анамнестической характеристике, представленной в таблице 1. 40 пациентов были рандомизированы на 2 исследуемые группы: I группа (n=20), получавшая в период обострения ПА мелоксикам 15 мг/сут после еды, 1 месяц; кальципотриол/бетаметазон, наружно, тонким слоем, 1 раз в сутки, 1 месяц; II группа (n=20), получавшая в период обострения ПА мелоксикам 15 мг/сут после еды, 1 месяц; кальципотриол/бетаметазон, наружно, тонким слоем, 1 раз в сутки, 1 месяц; «Остеомед форте» по 2 таблетки 2 раза в день во время еды, 1 месяц. Контрольную группу (КГ) составили 20 пациентов с ПА, не принимавших терапию. Длительность исследования составила 6 месяцев; пациенты исследуемых групп (n=40) в течение 5 месяцев продолжали терапию «Остеомед форте» по 2 таблетки 2 раза в день во время еды.
Таблица 1
Клинико-анамнестическая и лабораторная характеристика пациентов с псориатической артропатией («0» день исследования)
| Показатель | I группа (n=20) | II группа (n=20) | КГ (n=20) |
| Анамнестические данные | |||
| Пол (мужчины/женщины) | 13/7 | 14/6 | 9/11 |
| Возраст, годы: | 33,8±4,2 | 34,5±4,5` | 34,0±3,9 |
| Вес, кг | 76,7±5,1 | 77,0±5,3` | 75,9±5,2 |
| Рост, см | 168,2±5,0 | 170,2±5,2` | 171,3±5,5 |
| Длительность псориаза, годы | 12,5±1,3 | 11,9±1,1` | 12,1±1,2 |
| Длительность ПА, годы | 5,3±0,5 | 5,7±0,6` | 5,5±0,5 |
| Средняя частота рецидивов в год | 3,9±0,6 | 3,8±0,4` | 3,8±0,5 |
| Длительность рецидива, дни | 28,1±2,3 | 28,5±2,5` | 28,3±2,4 |
| Средняя продолжительность межрецидивного периода, мес. | 2,2±0,8 | 2,4±0,5` | 2,4±0,5 |
| Критерии ПА CASPAR, баллы | |||
| Псориаз:
псориаз в момент осмотра псориаз в анамнезе семейный анамнез псориаза |
2 0,5±0,2 0,5±0,2 |
2 0,5±0,3` 0,5±0,3` |
2 0,5±0,2 0,5±0,2 |
| Псориатическая дистрофия ногтей:
точечные вдавления, онихолизис, гиперкератоз |
1 |
1 |
1 |
| Отрицательный ревматоидный фактор (кроме метода латекс-теста) |
1 |
1 |
1 |
| Дактилит:
припухлость всего пальца в момент осмотра дактилит в анамнезе |
1 0,5±0,3 |
1 0,5±0,3` |
1 0,5±0,3 |
| Рентгенологические признаки внесуставной костной пролиферации по типу краевых разрастаний (кроме остеофитов) на рентгенограммах кистей и стоп |
1 |
1 |
1 |
| Лабораторные синдромы | |||
| АЦЦП, Ед/мл | 2,2±0,5 | 2,2±0,5` | 2,2±0,5 |
| СОЭ, мм/ч | 27,7±2,9 | 27,2±2,8` | 25,5±2,6 |
| СРБ, мг/л | 21,8±1,6 | 22,2±1,9` | 21,5±1,5 |
| HLA B27 антиген, нет/есть | 13/7 | 15/5 | 20/0 |
| Активность ПА | |||
| Минимальная активность ПА | 14 | 15 | 13 |
| Умеренная или высокая и при наличии факторов неблагоприятного прогноза | 6 | 5 | 7 |
Примечания. n-количество пациентов в группе; ПА – псориатическая артропатия; кг – килограмм; см – сантиметр; вероятность различий по t-критерию Стъюдента по показателям I группа / II группа: ` – недостоверные различия.
Для оценки клинической эффективности и безопасности стандартного и модифицированного режимов лечения ПА в «0» день и на «24» неделе применялись следующие методы исследования: анализ амбулаторных карт, истории болезни и жизни пациента, физикальные методы исследования, инструментальные и лабораторные методы исследования – ЭКГ (АТЕС МЕДИКА, Россия), ФГДС (GIF-E3,Olympus, Corp., Япония), УЗИ органов брюшной полости, почек и надпочечников, эхокардиография, рентгенографическое исследование кистей, стоп, таза (в прямой проекции) и переходного отдела позвоночника (нижне-грудного с захватом поясничного в боковой проекции) (SonoAce R3, Medison Samsung, Южная Корея), МРТ суставов для ранней диагностики (Intera 1,5T, Philips, Нидерланды), общеклинический анализ крови (Advia 120 «Bayer Diagnostics», Германия; Sysmex XT 2000i, Hoffman La Roche, Швейцария) и мочи (CLINITEK Advantus Urine Analyzer, Siemens,США), биохимический анализ крови, исследование уровня железа, трансферрина, СРБ, альбумина и глобулиновых факторов, ревматоидного фактора сыворотки крови, липидограммы (Olympus AU640, Япония), Ат к циклическому цитруллинированному пептиду, уровни Ат в крови к хламидиям (иммунохимический анализатор ARCHITECT i2000, Abbott Laboratories, США), бактериологическое исследование крови на стерильность, коагулограмма (ACL – 9000 и ACL Elite Pro, «Instrumentation Laboratory», США), общеклинический анализ синовиальной жидкости, HLA B27 антиген (цитометр FC 500, Beckman Coulter, США).
Молекулярное фенотипирование синовиальной жидкости выполнялось на этапах процедуры очистки (аффинная хроматография с лектином, Amersham Biosciences; Sigma, St.Louis, MO), разделения на белковые фракции методом одномерного электрофореза в полиакриламидном геле (SDS-PAGE) с идентификацией белков и пептидов методом масс-спектрометрического анализа на основе MALDI-TOF-МС (прибор Autoflex III, Bruker, США). Применяли программное обеспечение для протеомики и масс-спектрометрии (Flex Control, Flex Analysis 2.x с функцией Auto Xecute, ClinProTools 1.0., Biotools 3.0.) и идентификацию пептидного фингерпринта молекулярных маркеров в интегрированной базе данных Mascot Search (v2.1, Matrix Science, Великобритания). Результаты представлены в виде молекулярного профиля синовиальной жидкости, включающего выявленные белки с указанием Mr белков (Да). Условием для включения белка в диагностический профиль являлся показатель «покрытия сиквенса» при анализе масс-спектрограмм более 15%. Биоинформационный анализ межмолекулярных взаимодействий белков синовиальной жидкости проведен на основе программы STRING 9.1.
Мониторинг безопасности терапии включал оценку частоты, характера, выраженности, длительности неблагоприятных побочных реакций (НПР) и их связи с приемом препарата.
Для оценки активности ПА пациентом и врачом применялись показатели PsARC (Psoriatic Arthritis Response Criteria): число болезненных суставов из 68 (ЧБС), ЧПС (число припухших суставов из 66), PASI/ BSA (индексы тяжести и распространенности псориаза), ОБП (оценка боли пациентом по Визуальной Аналоговой Шкале, ВАШ), ОЗП (оценка активности заболевания пациентом по ВАШ), HAQ (функциональный индекс КЖ). Для оценки выраженности боли использовали 5-балльную шкалу Likert. Критериями эффективности терапии являлись оценка пациентом и врачом течения заболевания: улучшение (уменьшение общей оценки активности ПА пациент/врач на ≥ 1 пункт; уменьшение ЧБС/ЧВС на ≥ 30%); ухудшение (увеличение общей оценки активности ПА пациент/врач на ≥ 1 пункт; увеличение ЧБС/ЧВС ≥ 30%). Оценка кожного синдрома производилась в «0» день и через 6 месяцев терапии с помощью цифровой оценочной шкалы, пронумерованной от 0 до 10 (шкала зуда), общей оценки врачом активности псориаза по 5–бальной шкале Likert и PASI (Psoriasis Area and Severity Index). Влияние поражения кожи на повседневную деятельность пациентов оценивалось с помощью опросника DLQI (Dermatology Life Quality Index).
Статистическую обработку материала исследования проводили c применением пакета программ “Statistica 12.0”.
Результаты исследования и их обсуждение
При включении в исследование выявлены следующие группы пациентов: пациенты с преимущественным поражением дистальных межфаланговых суставов кистей и стоп (дистальная форма, n=18), асимметричным моноолигоартритом (n=25), симметричным полиартритом (ревматоидоподобная форма) (n=17). Все пациенты полностью завершили курс лечения в соответствии с протоколом исследования.
Изменения ЧБС, ЧВС, уровня боли и активности ПА по ВАШ, оцененные больным и врачом, представлены в таблице 2. Показана высокая частота наступления эффекта при приеме терапии с включением «Остеомед форте»: отмечено уменьшение уровней ЧБС, ЧВС, уровня боли и активности ПА по ВАШ после 6 месяцев лечения, снижение оценки активности болезни больным – на 37%, оценки активности болезни врачом – на 22% по сравнению с исходными значениями; менее выраженные изменения отмечены при применении стандартного режима терапии. При анализе динамики активности болезни по 5–бальной шкале Likert в начале и после 6 месяца терапии отмечено значимое улучшение во II группе пациентов по сравнению с I группой. Выявлено выраженное уменьшение индекса HAQ к концу 6 месяца во II группе пациентов по сравнению с I группой: среднее значение индекса снизилось на 40,5% от исходного во II группе (против 36% в I группе). У 18 (90%) пациентов II группы к концу 6 месяца модифицированной терапии достигнуто значимое уменьшение HAQ против 8 пациентов (40%) I группы. К концу лечения «ответчиками» в соответствии с PsARC стали 17% больных в I группе и 31% во II группе при отсутствии изменений в КГ. Наиболее выраженное улучшение индекса PASI, показателей шкалы зуда и DLQI к моменту окончания лечения отмечено во II группе. Статистически значимое уменьшение уровня СРБ отмечено к окончанию лечения в обеих исследуемых группах по сравнению с КГ; выраженное снижение СРБ отмечено во II группе пациентов, принимавших дополнительно «Остеомед форте» (таблица 2). НПР во время лечения препаратом «Остеомед форте» зарегистрированы не были.
Динамика молекулярных процессов, объясняющих изменения в суставах при ПА, представлена в таблице 3: на фоне приема базисной терапии и препарата «Остеомед форте» зарегистрировано уменьшение экспрессии в синовиальной жидкости катепсина G, матриксной металлопротеиназы 1, миелопероксидазы, белка, связывающего галектин-3, CРБ, белка S100A9, стромелизина 1, нейтрофильного альфа-дефензина 1, CD5-подобного белка, альфа-2-гликопротеина 1, содержащего лейцин, и увеличение экспрессии орозомукоида 1, профилина 1, гистона 4, ингибитора лейкоцитарной эластазы, пластина 2, C4b-связывающего белка по сравнению с КГ; менее выраженная динамика экспрессии белков-маркеров суставного синдрома наблюдалась в протеомном профиле синовиальной жидкости пациентов I группы. Протеомная карта оригинального состава трутневого расплода в составе препарата «Остеомед форте» позволила выполнить биоинформационный анализ межмолекулярных взаимодействий активных молекул белков и молекул белков синовиальной жидкости, что раскрывает механизм действия препарата.
Рассмотрим молекулярные механизмы реализации эффектов препарата «Остеомед форте» с учетом выявленной динамики протеомного профиля синовиальной жидкости на фоне терапии, а также знаний о протеомном составе трутневого расплода в препарате.
Идентифицированные белки синовиальной жидкости пораженного сустава относятся к 4 группам: белки острофазового сигнального ответа, белки гранулоцитарной адгезии и диапедеза, участники продукции окиси азота и СРО в макрофагах, белки межклеточной сигнализации и взаимодействия, клеточного цикла, антигенной презентации на поверхности клеток.
Альфа-дефензин 1 секретируется нейтрофилами в ответ на появление антигена. Его высокая экспрессия в синовиальной жидкости связана с воспалительной активностью при ПА. Альфа-дефензин 1 выполняет роль антимикробной защиты при синовиальном воспалении. Экспрессия альфа-дефензина 1 является хорошим индикатором прогрессирования ПА и эффективности средств его лечения. Дефензин 1 в трутневом расплоде в препарате «Остеомед форте» обладает противомикробным эффектом (рис. 1).
Увеличение экспрессии гем-содержащего фермента миелопероксидазы в синовиальной жидкости пациентов с ПА до приема терапии связано с активностью воспалительного процесса. Снижение активности данного белка в синовиальной жидкости, наиболее выраженное при приеме модифицированной терапии, может быть связано с активностью дефензина 1 и лизоцима 2 в составе препарата «Остеомед форте».
Снижение экспрессии CD5-подобного белка на фоне базисной терапии и «Остеомед форте» подтверждает наличие в молекулярном механизме действия последнего влияния на активированные при ПА Т-клетки, что делает данный маркер релевантным для оценки патологической активности клеточного иммунитета и выявления иммунотропного эффекта в спектре фармакодинамических эффектов средств лечения ПА.
Таблица 2
Оценка активности ПА и выраженности боли, динамика параметров кожным симптомов на фоне стандартной и модифицированной терапии
| № | Параметр | КГ (n=20),
«0» день исследования,М |
I группа (n=20),
«0» день исследования, М |
II группа (n=20),
«0» день исследования, М |
КГ (n=20),
«24» неделя исследования, М |
I группа (n=20),
«24» неделя исследования, М |
II группа (n=20),
«24» неделя исследования, М |
| 1 | ЧБС | 18 | 16 | 17,5 | 18,5 | 12 | 8 |
| 2 | ЧВС | 14,5 | 12 | 13,5 | 15 | 8 | 5 |
| 3 | Боль ВАШ, мм | 57 | 55,5 | 54,5 | 53 | 35 | 32 |
| 4 | Акт больной ВАШ,мм | 63 | 61,5 | 62 | 61 | 45 | 35 |
| 5 | Акт врач ВАШ,мм | 59 | 55 | 57 | 57 | 39 | 35 |
| 6 | Акт Likert больной | 3 | 3 | 3 | 3 | 2 | 1,5 |
| 7 | Акт Likert врач | 3 | 2,5 | 2,5 | 3 | 2,5 | 2 |
| 8 | HAQ | 1,55 | 1,47 | 1,43 | 1,53 | 0,94 | 0,85 |
| Параметры кожного синдрома | |||||||
| 1 | PASI | 8,6 | 9,2 | 8,8 | 8,8 | 6,8 | 5 |
| 2 | DLQI | 7,5 | 8,5 | 8,0 | 7,5 | 7,5 | 5,5 |
| 3 | Шкала зуда | 3 | 2,5 | 3 | 3 | 2,0 | 1,5 |
| Лабораторные параметры, M±SEM | |||||||
| 1 | СОЭ, мм/ч | 28,5±1,7 | 26,4±1,6 | 26,5±1,5` | 27,8±1,6 | 25,3±1,5` | 25,9±1,3` |
| 2 | СРБ, мг/л | 22,4±1,4 | 21,6±1,2 | 22,5±1,5` | 22,0±1,1 | 15,4±0,8* | 8,7±0,3* |
Примечания. ЧБС – число болезненных суставов, ЧВС – число воспаленных суставов, ВАШ – визуальная аналоговая шкала, HAQ – Health Assessment Questionare; PASI- композитная оценка эритемы, инфильтрации, шелушения и площади псориатической бляшки, DLQI-шкала оценки влияния поражения кожи на повседневную деятельность пациентов, М-среднее значение, SEM – стандартная математическая ошибка; вероятность различий по t-критерию Стъюдента по показателям I группа / II группа в «0» день исследования; вероятность различий по t-критерию Стъюдента по показателям в I группе в «0» день и через «24» недели исследования, во II группе в «0» день и через «24» недели исследования: ` – недостоверные различия; * – p<0,001.
Таблица 3
Динамка протеомного профиля синовиальной жидкости у пациентов с ПА (%) на фоне приема стандартной и модифицированной терапии
| № | Название белка | Mr,Да | КГ (n=20),
«0» день исследования, % |
I группа (n=20),
«0» день исследования, % |
II группа (n=20),
«0» день исследования, % |
КГ (n=20),
«24» неделя исследования,% |
I группа (n=20),
«24» неделя исследования, % |
II группа (n=20),
«24» неделя исследования, % |
| 1 | Орозомукоид 1 | 23603 | 25 | 30 | 25 | 25 | 65 | 80 |
| 2 | Катепсин G | 28837 | 75 | 70 | 80 | 75 | 65 | 25 |
| 3 | Профилин 1 | 15054 | 40 | 65 | 60 | 45 | 70 | 90 |
| 4 | Гистон 4 | 11367 | 25 | 40 | 45 | 75 | 70 | 80 |
| 5 | Mатриксная металлопротеиназа 1 | 22000 | 100 | 90 | 90 | 100 | 80 | 25 |
| 6 | Ингибитор лейкоцитарной эластазы | 26073 | 35 | 35 | 30 | 35 | 60 | 70 |
| 7 | Миелопероксидаза | 83869 | 70 | 75 | 65 | 70 | 70 | 40 |
| 8 | Пластин 2 | 21792 | 35 | 30 | 30 | 35 | 60 | 75 |
| 9 | Галектин-3-связывающий белок | 65331 | 90 | 90 | 90 | 90 | 70 | 20 |
| 10 | C4b-связывающий белок | 67033 | 20 | 30 | 20 | 20 | 45 | 75 |
| 11 | CРБ | 25039 | 100 | 100 | 100 | 100 | 80 | 30 |
| 12 | Белок S100A9 | 13242 | 100 | 100 | 100 | 100 | 85 | 30 |
| 13 | Стромелизин 1 | 53977 | 90 | 90 | 95 | 90 | 70 | 25 |
| 14 | Нейтрофильный альфа-дефензин 1 | 10201 | 90 | 90 | 90 | 85 | 75 | 40 |
| 15 | CD5-подобный белок | 38088 | 75 | 70 | 75 | 75 | 65 | 45 |
| 16 | Альфа-2-гликопротеин 1, содержащий лейцин | 38178 | 60 | 65 | 65 | 60 | 45 | 25 |
Примечание. ПА – псориатическая артропатия; n-количество пациентов в группе; Mr-молекулярная масса; Да – дальтон; % – количество пациентов в %; СРБ-С-реактивный белок; CD – кластер дифференцировки.
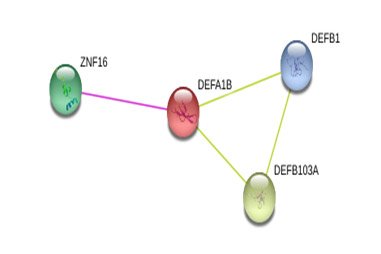
Рисунок 1. Межмолекулярные взаимодействия дефензина 1 (гомогенат трутневого расплода как компонент «Остеомед форте»)
Примечания. DEFA1B-дефензин-1B; DEFB103A-бета-дефензин; ZNF16–белок 16, содержащий цинк; DEFB1 – бета-1- дефензин.
Значимое уменьшение экспрессии матриксной металлопротеиназы 1 в синовиальной жидкости сустава при приеме «Остеомед форте» в режиме лечения ПА свидетельствует о снижении интенсивности патологического ремоделирования в суставных тканях за счет защиты от разрушения коллагена I, II и III типов. Снижение экспрессии стромелизина 1 в синовиальной жидкости при приеме модифицированной терапии ПА отражает уменьшение активности процессов деградации фибронектина, ламинина, желатинов I, III, IV и V типов, коллагена III, IV, IX и X, протеогликанов суставного хряща (рис. 2).
Уменьшение высокой экспрессии катепсина G в синовиальной жидкости, наиболее выраженное во II группе, связано со снижением интенсивности ремоделирования соединительной ткани в участках воспаления. Снижение экспрессии катепсина G ассоциировано с увеличением экспрессии ингибитора лейкоцитарной эластазы в синовиальной жидкости при применении «Остеомед форте». Последняя уменьшает гибель клеток суставных тканей, индуцируемую катепсином G при ПА. Значимое уменьшение высокой экспрессии альфа-2-гликопротеина 1, содержащего лейцин, во II группе с ПА свидетельствует о снижении интенсивности воспалительного процесса и неоваскуляризации в суставных тканях, опосредованной фактором роста опухоли – бета.
Снижение экспрессии белка S100A9 на фоне базисной терапии и «Остеомед форте» в синовиальной жидкости при ПА отражает устранение интенсивности воспаления, поддерживаемого в суставе неоваскуляризацией суставных тканей и привлечением лейкоцитов в очаг воспаления. Прием базисной терапии ПА и «Остеомед форте» сопровождался уменьшением экспрессии белка, связывающего галектин-3, в синовиальной жидкости. Данный факт свидетельствует о снижении выраженности иммунного ответа в суставных тканях, связанного с естественными киллерами и клеточной цитотоксичностью, во II группе пациентов с ПА.
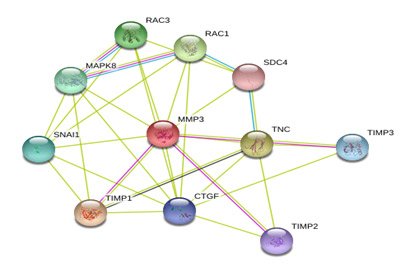
Рисунок 2. Межмолекулярные взаимодействия стромелизина 1 в синовиальной жидкости
Примечания. MMP3 – стромелизин 1; TIMP1 – ингибитор металлопротеиназ 1; TNC – тенасцин C; RAC1 – ras-связанный C3 субстрат ботулинового токсина 1; RAC3 – ras-связанный C3 субстрат ботулинового токсина 3; MAPK8 – МАР-киназа 8; SNAI1 – спиралевидный белок 1; TIMP3 – ингибитор металлопротеиназ 3; CTGF – ростовой фактор соединительной ткани; TIMP2 – ингибитор металлопротеиназ 2; SDC4 – синдекан 4.
Увеличение экспрессии белка орозомукоида 1 в синовиальной жидкости на фоне приема модифицированного режима терапии отражает участие молекулы в иммуносупрессивном эффекте базисной терапии и препарата «Остеомед форте» при ПА. Наибольшее увеличение экспрессии белка профилина 1 в синовиальной жидкости во II группе свидетельствует об эффективном восстановлении процессов полимеризации актина в ответ на внеклеточные сигналы. Рост экспрессии гистона 4 в синовиальной жидкости в I группе и в большей степени во II группе пациентов свидетельствует о стабилизации хроматинового материала в клетке и устранении эпигеномных перестроек при ПА на фоне терапии. Существенное увеличение экспрессии пластина 2 в синовиальной жидкости пораженного сустава при ПА в условиях приема базисного режима терапии и «Остеомед форте» отражает реставрацию репликативной активности клеток тканей суставов. Увеличение экспрессии C4b-связывающего белка и уменьшение экспрессии СРБ в синовиальной жидкости пораженного сустава при ПА на фоне приема «Остеомед форте» пациентами способствует блокаде классического и лектин-ассоциированного пути комплемента в суставных тканях.
Представлены межмолекулярные взаимодействия витамина D3, содержащегося в препарате «Остеомед форте», механизм действия которого связан с активацией рецептора к витамину D, индукцией транскрипционных факторов и рецепторов ядра. Конечным эффектом витамина D3 является поддержание кальциевого гомеостаза при формировании костной ткани, в т.ч., контроль клеточного роста, дифференцировка и апоптоз, что делает перспективной данную молекулу для терапии ПА (рис. 3).
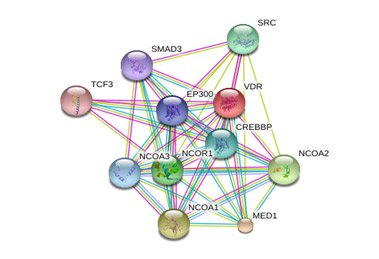
Рисунок 3. Межмолекулярные взаимодействия витамина D3 (компонент препарата «Остеомед форте»)
Примечания. VDR-рецептор к 1,25-дигидровитамину D3; MED1-субъединица-1 медиаторного комплекса; NCOA1 – коактиватор-1 ядерного рецептора; NCOA2 – коактиватор-2 ядерного рецептора; NCOR1 – корепрессор-1 ядерного рецептора; SRC – гомолог вирусного онкогена Шмидта-Руппина A-2; CREBBP-CREB связывающий белок; NCOA3 – коактиватор-3 ядерного рецептора; EP300-E1A-связывающий белок p300; SMAD3 – член 3 семейства SMAD; TCF3 – транскрипционный фактор-3.
Исследование показало, что препарат «Остеомед форте» обладает отчетливым симптом–модифицирующим действием в отношении суставного синдрома у больных с ПА, подтвержденным положительной динамикой показателей стандартных методов исследования и обусловленным молекулярными звеньями механизма действия препарата «Остеомед форте» на фоне базисной терапии ПА.
Таким образом, результаты исследования позволяют рассматривать «Остеомед форте» как высокоэффективный препарат для лечения активного ПА с хорошей переносимостью. Перспективы дальнейшего применения препарата в комплексной терапии ПА связаны с его потенциальными возможностями замедлять прогрессирование заболевания и уточнением его фармакодинамических эффектов.
Выводы
- Обнаружена высокая эффективность и безопасность приема препарата «Остеомед форте» в составе стандартной терапии ПА.
- Выявлены ключевые молекулярные звенья реализации фармакодинамических эффектов препарата «Остеомед форте» у пациентов с ПА.
- Продемонстрирована целесообразность дальнейшего поиска новых молекул мишеней для разработки лекарственных средств для лечения ПА.
Список литературы
- Галлямова Ю. А. Псориатическая артропатия // Лечащий Врач. – 2008, 3:28.
- Знаменская Л.Ф., Мелехина Л.Е., Богданова Е.В., Минеева А.А. Заболеваемость и распространенность псориаза в Российской Федерации // Вестник дерматологии и венерологии. – 2012, 5: 20-29.
- Пирузян Л. А., Голденкова И.В., Корсунская И.М., Пирузян А.Л., Абдеев Р.М., Матишов Д.Г., Сарвилина И.В., Горшкова Ю.В., Шин Е.Ф. Экогенетические аспекты при создании протоколов ведения пациентов с псориазом// Научн.-практ. журнал «Проблемы стандартизации в здравоохранении». – 2006, 6:7-14.
- Ellis C., Hermann R., Gorsulowsky D., Goldfarb M., Voorhees J. Etretinate therapy reduces inpatient treatment of psoriasis//J Am Acad Dermatol.-1987, 17:787-791.
- Feldmann S., Garton R., Averrett W., Balkrishnan R., Vallee J. Strategy to manage the treatment of severe psoriasis: considerations of efficacy, safety and cost //Expert Opin Pharmacother.-2003, 4:1525 – 1533.
- Henseler T., Christophers E. Psoriasis of early and late onset: characterization of two types of psoriasis vulgaris // J Am Acad Dermatol.-1985,13 : 450-456.
- Mease P., Goffe B., Metz J. et al. Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomised trial // Lancet. – 2000, 356;9227:385–390.
- Mease P., Ory P., Sharp J. et al. Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT) // Ann Rheum Dis. – 2009, 68; 5:702–709.
Резюме
Исследование показало положительную динамику показателей активности псориатической артропатии, что обусловлено молекулярными звеньями механизма действия препарата «Остеомед форте» на фоне базисной терапии. «Остеомед форте» является перспективным препаратом с хорошей переносимостью для лечения активной псориатической артропатии и ее профилактики.
Summary
The research has shown positive dynamics of psoriatic arthritis indicators that is caused by molecular links of the mechanism of “Osteomed Forte” action with basic therapy. “Osteomed Forte” is very perspective drug with good tolerance for the treatment and prophylaxis of active psoriatic arthritis.





