Данная монография о проблемах остеопороза вышла в свет в 2009 году. Пензенский профессор Виллорий Струков более полувека исследовал больных остеопорозом и изложил в работе свои взгляды на поистине мировую проблему потери человеком костной массы, перечислил методы лечения остеопороза, известные миру препараты. Эта работа была написана до того, как компания «Парафарм» выпустила препарат «Остеомед», который совместно разработали ученые — профессор В.И. Струков и физиолог В.Н. Трифонов.
Виллорий Иванович — постоянный участник и лектор всемирных конгрессов по костным заболеваниям. В своей врачебной практике он использовал различные способы лечения остеопороза и переломов, в том числе импортными препаратами — к примеру, американским «Цитракалом». Тем не менее, сегодня профессор Струков говорит о том, что «Остеомед» превзошел его ожидания, так как при его приеме скорость восстановления костной ткани гораздо выше импортных препаратов. А чем быстрее реабилитация человека, тем выше вероятность предотвратить повторный перелом.
С 2009 года Виллорий Иванович начал применять в своей врачебной практике «Остеомед». Результат — на сегодняшний день более чем у 10 тысяч его пациентов не наблюдались повторные переломы. Надо заметить, что такой заслуги нет ни у одного иностранного лекарственного препарата, предназначенного для лечения остеопороза.
“Актуальные проблемы остеопороза”.
Монография
под редакцией
профессора, доктора медицинских наук,
зав. кафедрой педиатрии ГОУ ДПО
Пензенского института усовершенствования врачей
В.И. Струкова.
Авторский состав:
В. И. Струков,
М. Ю. Сергеева-Кондраченко,
О. В. Струкова-Джоунс,
Р. Т. Галеева, Л. Г. Радченко,
М. Н. Гербель, Е. Б. Шурыгина,
Л. Д. Романовская, Н. В. Еремина,
Н. А. Вирясова.
Рецензенты:
Л. М. Житникова, д.м.н., профессор кафедры семейной медицины
ММА им. И.М. Сеченова,
исполнительный директор Общероссийской Ассоциации
врачей общей практики.
В. А.Кельцев, д.м.н., профессор,
заведующий кафедрой факультетской педиатрии
ГОУ ВПО Самарского медицинского университета.
Типография «Ростра», 2009. с.342
Содержание
Профилактика остеопороза
Профилактика: первичная – в группах риска; вторичная – предупреждение переломов:
- физическая активность – гимнастика, изометрические упражнения, плаванье;
- правильное питание – высокое содержание белка, кальция, витамина D, молочные продукты, низкое содержание фосфатов, поваренной соли, клетчатки;
- устранение факторов риска ОП – курения, алкоголя, кофеина (более 4 чашек в день), тяжелых нагрузок;
- снижение риска факторов падения и переломов – коррекция нарушений зрения, исключение седатации;
- прием препаратов – кальций и витамин D (особенно в холодное время года).
Поскольку остеопороз в значительной мере является педиатрическим детерминированным заболеванием, то его профилактику можно разделить на 3 этапа:
I этап. Достижение как можно более высокой пиковой костной массы у детей и подростков к 20-летнему возрасту. Основное значение имеют следующие мероприятия, направленные на устранение различных факторов, негативно влияющих на моделирование и ремоделирование костной ткани:
- широкий охват естественного вскармливания детей до года;
- рационное питание с включением продуктов, богатых солями кальция;
- активный образ жизни;
- достаточное пребывание на свежем воздухе (УФО);
- специфическая профилактика рахита по расширенным показаниям. Назначение витамина D (профилактические курсы) всем детям в период интенсивного вытяжения, особенно в пубертатном периоде.
II Этап. Сохранение достигнутого к 20 годам максимума МПКТ в зрелом возрасте до наступления менопаузы, устранение моделируемых факторов риска остеопороза:
- сбалансированное питание с достаточным поступление солей Са, витаминов;
- постоянные физические нагрузки;
- здоровый образ жизни;
- ограничение алкоголя и алкогольсодержащих продуктов (особенно пива);
- исключение курения;
- снижение заболеваемости желудочно-кишечного тракта, почек, печени;
- снижение эндокринных заболеваний; минимизация ятрогенных причин ОП.
III Этап. Удержание максимума пиковой костной массы у лиц старше 50-65 лет, особенно в период постменопаузы. Ранняя диагностика остеопороза и групп риска по костным переломам. Устранение факторов риска падений:
- соблюдение положений п.II;
- проведение с пациентами образовательных программ;
- по расширенным показаниям проведение заместительной гормональной терапии;
- профилактика падений;
- защита проксимального отдела бедра с помощью протектора и т.д.;
- устранение болевого синдрома, расширение двигательной активности, улучшение качества жизни.
В настоящее время для профилактики и патогенетического лечения остеопороза используются разнообразные лекарственные средства. Их условно можно подразделить на три группы:
Препараты, подавляющие резорбцию костной ткани:
- эстрогенные гормоны (“Девина”, “Дивигель”, “Дивитрен”, “Эстрофем”, “Климен”, “Климонорм”, “Тиболон” и др.);
- кальцитонин;
- бисфосфонаты (“Алендронат”, “Клодронат”, “Акласта” и др.);
- препараты кальция;
- витамин D (“Кальциферол”, “Холекальциферол”);
- активные метаболиты витамина D (“Кальцитриол”, “Альфакальцидол”);
- тиазидные диуретики;
- оссеин – гидроксиапатит;
- анаболические стероиды (“Оксандролон”, “Нандролон”, “Станозол”).
Препараты, увеличивающие костную массу:
- производные фтора (фторид натрия, монофлюрофосфат);
- анаболические стероиды;
- иприфловоны;
- оссеин – гидроксиапатит;
- пептид (1-34) ПТГ;
- простагландин Е;
- гомон роста;
- паратгормон.
Средства, влияющие на оба эти процесса:
- витамин D: холекальциферол (D3), эргокальциферол (D2);
- активные метаболиты витамина D: кальцитриол, альфадол (“Оксидевит”, “Альфа Dз-ТЕВА”);
- сочетание кальция и витамина D.
Широко используется как моно, так и комбинированная терапия препаратами указанных групп (“Идеос”, “Кальций Dз НИКОМЕД”, “Альфадол кальция”, карбонат кальция, цитрат кальция и др).
Устранение болевого синдрома – парацетамол, НПВС, феброфид и др.
Лечение остеопороза
Выбор препарата определяют:
- скорость снижения МПК;
- наличие сопутствующих заболеваний;
- индивидуальная непереносимость;
- возможность мониторинга;
- стоимость.
Эффективность лечения определяют:
- динамика денситометрии через 6-12 месяцев;
- динамика биохимических маркеров через 3 месяца.
Кто должен получать лечение?
- Женщины в постменопаузальном периоде и мужчины старше 50 лет.
- Если у пациентов в шейке бедра или позвоночнике – по Т-шкале значение ≤ -2,5 СО.
- Пациенты с низкой костной массой (по Т-шкале между -1 и – 2,5 СО и с 10-летним риском перелома шейки бедра ≥ 3% или остеопоротических переломов с вероятностью ≥ 20% по алгоритму ВОЗ).
Для лечения уже развившегося остеопороза и предупреждения возникновения новых переломов используется весь арсенал современных медикаментозных средств в виде как моно, так и комбинированной терапии. Следует подчеркнуть, что в настоящее время основным критерием эффективности лекарства при лечении остеопороза является снижение частоты новых переломов костей при 3-5-летнем наблюдении и увеличение МПК, определяемое с помощью костных рентгеновских денситометров, нормализация маркеров костного метаболизма.
Общие механизмы действия антирезорбтивных агентов по уменьшению риска переломов направлены на снижение костной резорбции и повышение образования новой кости. При этом сохраняется или повышается количество костной массы, повышается МПК, снижается повышенный обмен, снижается кортикальная порозность, поддерживается жизнеспособность остеоцитов. Лечение способствует сохранению трабекул и снижению механического стресса. Считают, что повышение МПК в позвоночнике на 8% или бедре на 5% снижает риск переломов позвонков примерно на 50%, непозвоночных переломов на 35%. Ряд препаратов не дает высокого прироста МПК, хотя снижает частоту переломов. Полагают, что антирезорбтивные лекарства, которые не повышают или мало повышают МПК, вместе с тем снижают риск переломов приблизительно на 20-25%, вероятно, за счет уменьшения резорбции.
Патогенетическая терапия остеопороза включает препараты, замедляющие костную резорбцию: бисфосфонаты, кальцитонины (миакальцик), селективные модуляторы эстрогенных рецепторов (СМЭР), эстрогены; медикаменты, преимущественно усиливающие костеобразование: ПТГ, фториды, анаболические стероиды, андрогены, соли стронция, гормон роста; средства, оказывающие многостороннее действие на костную ткань (витамин D и его активные метаболиты, остеогенон, Бениваленская Л.И., Лесняк О.М., 2005 г.).
Бисфосфонаты
Согласно рекомендациям Американской ассоциации по остеопорозу, в настоящее время первую позицию в лечении остеопороза занимают бисфосфонаты – единственные препараты с доказанной эффективностью в снижении переломов, особенно глюкокортикоидной этиологии. В России зарегистрированы препараты “Алендронат” (“Фосамакс”), который относится к азотсодержащим бисфосфонатам.
“Алендронат” (“Фосамакс”)
Цель профилактики и лечения остеопороза — обеспечить прирост массы кости, снизить частоту и риск переломов, улучшить качество кости. “Алендронат” показал высокую эффективность: МПК повысилась во всех областях в измерения — от 5,4% в шейке бедра до 13,7% в позвоночнике (уровень доказательности А), частота переломов в позвоночнике достоверно снизилась на 47%, в бедре — на 51—56%, в предплечье — на 8%, прогрессирование деформаций позвонков уменьшалось у 64% у больных (уровень доказательности А). В исследовании приняло участие 1258 женщин в постменопаузе с остеопорозом. Сравнивались группы пациентов, принимавших 70 мг “Алендроната” 1 раз в неделю с ежедневным приемом 10 мг. Прирост МПК составил 6,8 и 7,4% соответственно в позвоночнике, 4,1 и 4,3% в бедре (Л.И. Беневоленская, О.М. Лесняк, 2005 г.).
“Фосамакс” (“Алендронат”) назначают по 70 мг 1 раз в неделю либо по 10 мг ежедневно длительно, в течение 3-5 лет, особенно при тяжелом остеопорозе у пациентов с переломами. Точная длительность терапии не определена. “Алендронат” следует принимать за 30 мин. до еды или и спустя 2 ч после завтрака, запивая простой водой (полный стакан), сохраняя вертикальное положение тела в течение 30 минут после приема для лучшего прохождения таблетки через пищевод.
“Алендронат” показал значительный прирост МПК и уменьшение частоты переломов позвонков у мужчин с остеопорозом, а также хорошие результаты при лечении глюкокортикоидного остеопороза.
“Фосамакс” использовать в комбинации с другими препаратами гормональной заместительной терапии, ПТГ, витамином D (500 МЕ) и его активными метаболитами, препаратами кальция (1000 мг).
“Акласта” (ACLASTA®). Золедроновая кислота. Фирма Новартис Штейн АГ Швейцария. Раствор для инфузий 100 мл в полиэтиленовом флаконе. 1 флакон содержит 5,0 мг золедроновой кислоты безводной.
Показания.
- постменопаузальный остеопороз (для снижения риска переломов бедренной кости, позвонков и невертебральных переломов, для увеличения минеральной плотности кости);
- лечение костной болезни Педжета.
Дозы и способ применения. Венное ведение препарата с помощью клапанной инфузионной системы, обеспечивающей постоянную скорость инфузий, в течение не менее 15 мин.! Для лечения постменопаузального остеопороза рекомендуемая доза “Акласты” составляет 5 мг (содержимое одного флакона препарата – 100 мл раствора) внутривенно 1 раз в год.
Для лечения болезни Педжета рекомендуется доза “Акласты” – 5 мг (содержимое одного флакона – 100 мл раствора) однократно.
У пациентов с клиренсом креатинина г 30 мл/мин. не требуется коррекции дозы препарата.
Противопоказания.
- Повышенная чувствительность к золедроновой кислоте или к любому другому бисфосфонату.
- Тяжелые нарушения минерального обмена, включая гипокальциемию.
- Беременность, период кормления грудью.
- Дети и подростки до 18 лет (т.к. безопасность и эффективность применения “Акласты” у данной категории больных не изучались).
“Акласту” не рекомендуется применять пациентам с тяжелыми нарушениями функции почек (клиренс креатинина < 30 мл/мин.).
Меры предосторожности
Перед применением “Акласты” следует определить уровень креатинина сыворотки крови. Перед введением, а также после инфузий препарата следует обеспечить адекватную гидратацию организма больного. Это особенно важно для больных, получающих терапию диуретиками, а также для пациентов в возрасте старше 65 лет). При наличии гипокальциемии перед началом терапии “Акластой” необходимо провести лечение адекватными дозами кальция и витамина D. Также следует провести терапию других имеющихся нарушений минерального обмена (например, связанных с нарушением функции паращитовидных желез, снижением всасывания кальция в кишечнике). Врачу следует обеспечить регулярное наблюдение за данной категорией больных.
При применении бисфосфонатов, включая “Акласту”, изредка могут отмечаться выраженные боли в костях, суставах и мышцах, в ряде случаев сопровождаться ограничением подвижности. Золедроновая кислота является действующим веществом как “Акласты”, так и “Зометы” (препарата для лечения онкологических пациентов).
При необходимости проведения стоматологических манипуляций пациент должен проинформировать стоматолога о терапии препаратом.
Следует соблюдать осторожность при одновременном применении “Акласты” с препаратами, которые способны оказывать влияние на функцию почек (например, аминогликозидами или диуретинами, вызывающими дегидратацию).
Побочное действие
Все нежелательные явления обычно умеренно выражены и имеют преходящий характер: повышение температуры тела, головная боль, головокружение, тошнота, рвота, диарея, миалгия, артралгия, боль в костях, боль в спине и конечностях, гриппоподобный синдром. При болезни Педжета: озноб, повышенная утомляемость, астения, боль, общее недомогание, дрожь, гипокальциемия, головная боль. Иногда: заторможенность (при болезни Педжета), парестезии, сонливость, тремор, обмороки, нарушения вкуса, диспепсия, боль в животе, ощущение сухости во рту, эзофагит, отек суставов, анорексия, конъюнктивит, боль в глазах, увеит, сыпь, транзиторное повышение уровня креатинина в плазме крови, периферические отеки и жажда.
При внутривенном введении бисфосфонатов, включая золедроновую кислоту, отмечались случаи нарушения функции почек, покраснение и отечность кожи и/или болезненность в месте введения. Случаи развития остеонекроза (наиболее часто – челюсти) имели место в основном у онкологических пациентов, получающих лечение бисфосфонатами, включая золедроновую кислоту, после экстракции зуба или иных стоматологических манипуляций. В одном клиническом исследовании “Акласты” у пациенток с постменопаузальным остеопорозом отмечено небольшое повышение частоты развития фибрилляции предсердий.
“Ризедронат” (“Актонель”) назначается в дозе 2,З5 или 5 мг одновременно с 1000 мг кальция и 500 МЕ витамина D в течение 1-3 лет ежедневно, достоверно снижает частоту переломов от 30 до 40%. В России практически не применяется.
“Ксидифон” (калий-натриевая соль 1-гидроксиэтилиден-1, 1-бисфосфоновой кислоты) применяется в России для лечения остеопороза. Выпускается в виде 20% раствора, перед употреблением разводят дистиллированной водой до 2% раствора. Применяют по 5-10 мг/кг массы тела 2-месячными курсами с 1-месячным перерывом в течение 1 года. Указывается на его способность улучшать МПК, в том числе тел позвонков. Отсутствуют данные о снижении риска возникновения переломов.
Кальцитонин – гормон паращитовидных желез, состоит из 32 аминокислот, обладает выряженным гипокальциемическим и гипофосфатемическим действием за счет угнетения активности остеокластов и снижает резорбцию косной ткани. Кальцитонин относится к препаратам второй очереди, который повышает минеральную плотность костей, однако его способность снижать частоту костных переломов не доказана. Кальцитонин применяется парентерально (подкожно, внутримышечно) или в виде назального спрея. Интразональное введение миокальцика предпочтительнее, так как кальцитонин хорошо всасывается в кровь через слизистую носа и имеет меньше побочных эффектов. Чаще используется кальцитонин лосося, который в 30-40 раз сильнее биологического действия человеческого. Чаще применяют кальцитонин лосося по 100 МЕ в инъекциях и по 200 МЕ назально курсами по 2-3 месяца с такими же перерывами. Способствует повышению минеральной плотности в позвоночнике и бедре, снижает интенсивность болевого синдрома, связанного с компрессионными переломами тел позвонков.
Основные показания для кальцитонина являются постменопаузальный остеопороз, для профилактики стероидного остеопороза, для лечения болевого синдрома при компрессионных переломах позвонков.
Терапию кальцитонином необходимо проводить в комбинации с препаратами кальция (500-1000 мг/сут.) и витамином D (400-800 МЕ/сут.). Возможны побочные эффекты в виде анафилаксии редко при парентеральном введении. При назальном длительном введении явления раздражения слизистой оболочки у 20-30% случаев применения. Реже могут быть малые носовые кровотечения (15%), изъязвления слизистой носа. В большинстве случаев эти побочные реакции выражены в легкой степени и не требуют отмены препарата.
Эстрогены, гестагены, их гомологи и антагонисты
Фармакологическое действие – эстрогенное, ингибирующее костную резорбцию. Селективный модулятор эстрогеновых рецепторов. Действует как агонист на нерепродуктивные ткани, как антагонист – на репродуктивные. Избирательно атакует эстрогенчувствительные мембраны, участвует в регуляции экспрессии генов. Увеличивает концентрацию глобулинов, связывающих половые гормоны, тироксин, кортикостероиды, с одновременным нарастанием их общего содержания в крови. Нормализует процессы костной резорбции в постменопаузном периоде, повышает массу костной ткани, снижает потери кальция через мочевыделительную систему. Уменьшает общий холестерин, холестерин ЛПВП, фибриноген сыворотки и увеличивает субфракцию ЛПВП-С2.
“Бивалос” (стронция ранелат) – препарат, влияющий на метаболизм костной ткани. В исследованиях in vitro показано, что стронция ранелат стимулирует формирование кости, повышает минеральную плотность костей, применяют при постменопаузном остеопорозе, дозировка – суточная доза – 2 г. Курс лечения “Бивалос” длительный [42, 43, 44, 45, 46]. Клинические исследования по влиянию стронция ранелата на костную ткань были начаты в 1991 г. Стронций (СР)— двухвалентный катион занимает 15-е место по частоте встречаемости в земной коре. СР, применяемый в медицинских целях, содержит 2 атома стабильного стронция, связанных с ранеловой (органической) кислотой. На основании исследований было доказано, что СР обладает направленным действием на костную ткань: стимулирует костеобразов и подавляет костную резорбцию [48, 50, 51, 52, 53].
Точный механизм действия СР неизвестен. Высказываются гипотезы, что СР реализует свои эффекты через кальций-чувствительный рецептор или какой-то другой катион- чувствительный рецептор; влияет на систему RANK/RANKL и выработку факторов роста, зависящих от простагландина Е2.Теоретический расчёт элиминации стронция из костной ткани показал, что первая быстрая фаза выведения (период полувыведения 41 день) сменяется фазой медленного выведения с периодом полувыведения до года. Вторая фаза выведение стронция стимулируется витамиом D и подавляется бисфосфонатами.
Использование стронция ранелата (СР) для лечения постменопаузального остеопороза
Исследования, посвящённые отработке дозировки препарата, показали, что минимальная терапевтическая доза стронция ранелата 1 г/день приводит к достоверному увеличению МПК поясничных позвонков на 5,83% (2,4%) при пересчёте на атомы стронция), шейки бедра на 4,78% и всего бедра на 4,68 (3,21%) за 2 года лечения. СР в дозе 2 г/день приводит к достоверному увеличению МПК поясничных позвонков на 7,3% (3%) (р<0,001) за год. Достигается статистически значимое снижение риска переломов позвонков на 44% за 2 года лечения [58].
При анализе результатов трёхлетнего лечения СР показано, что приём СР позволил снизить относительный риск переломов позвонков на 49% за первый год лечения и на 41% в течение трёхлетнего периода исследования. Через 4 года применения СР наблюдалось снижение риска переломов позвонков на 33% [49]. По результатам исследования TROPOS МПК, в группе лечения через 3 года увеличилась на 5,7% в шейке бедра и на 7,1% в целом в бедре. Относительный риск перелома позвонков снижался на 45% за первый год исследования и на 39% через 3 года лечения [46, 47].
Исследование эффективности препарата у мужчин не закончено. И в настоящее время данных по использованию препарата у мужчин при глюкокортикоидном остеопорозе нет.
Побочные эффекты. По данным метаанализа, 4 исследований “Бивалос” в дозе 2 г/сут. ежедневно увеличивает риск диареи. Кроме того, при дозе 2 г/сут. в группе, получавшей СР, была выявлена большая частота венозных тромбозов и тромбоэмболии лёгочных сосудов. Также несколько чаще выявляли нарушения со стороны нервной системы, такие как головная боль (3,9%), судороги (0,3%), потеря памяти (2,4%) и нарушение сознания (2,5%). Расстройства нервной системы встречались чаще через 4 года терапии.
Таким образом по “Бивалосу” можно сделать следующее заключение:
- Стронция ранелат увеличивает МПК позвонков и проксимальных отделов бедренной кости и уменьшает риск переломов тел позвонков, периферических переломов у женщин с постменопаузальным остеопорозом (А).
- Стронция ранелат не нарушает структуру костной ткани (В).
- Наличие предшествующих переломов, наследственная предрасположенность к остеопорозу, исходный индекс массы тела, базальная МПК не влияют на эффективность лечения стронцием ранелатом (В).
- Длительность лечения стронция ранелатом составляет 3-5 лет, при этом безопасность лечения оценена за период лечения до 8 лет (С).
- Стронция ранелат — препарат первой линии для лечения остеопороза у женщин в постменопаузе (А).
Стронция ранелат необходимо назначать в сочетании с кальцием и витамином D в дозировках с учетом их пищевого потребления (С).
Селективные модуляторы эстрогенных рецепторов (СМЭР)
СМЭР – химические соединения негормональной природы, которые прочно связываются с рецепторами эстрогенов. В одних тканях (костная ткань) они проявляют себя как агонисты эстрогенов, а в других (эпителий молочных желез) — как антагонисты женских половых гормонов. Из значительного количества соединений, определяемых как СМЭР, пока только ралоксифен одобрен для профилактики и лечения остеопороза. Его назначают по 1 таблетке (60 мг) в день вне зависимости от приема пищи и времени дня в сочетании с кальцием и витамином D. “Ралоксифен” оказывает эстрогеноподобное действие на костную ткань и метаболизм липидов и антиэстрогенное действие на эндометрий и эпителий молочных желез. “Ралоксифен”быстро всасывается после приема внутрь. Биодоступность – около 60%. При “первом прохождении” через печень подвергается интенсивному конъюгированию с глюкуроновой кислотой (абсолютная биодоступность неизмененного препарата составляет только 2%). Концентрация в крови поддерживается за счет кишечно-печеночной рециркуляции. У пациентов с печеночной недостаточностью уровень ралоксифен в крови в 2,5 раза выше и коррелирует с концентрацией билирубина в среднем 28 ч. Почечная недостаточность значительно удлиняет циркуляцию ралоксифена, у таких больных в течение 5 дней выводится (с мочой) только 6% дозы [59-67].
Влияние ралоксифена на кости. “Ралоксифен” предотвращает переломы костей у женщин в постменопаузе с остеопорозом (Т-критерий ниже -2,5 в поясничных позвонках и шейке бедра). “Ралоксифен” достоверно уменьшал частоту новых переломов тел позвонков у лиц как с предшествующими переломами (на 30%), так и без таковых (на 50%). Однако риск возникновения внепозвоночных переломов препарат достоверно не уменьшал [63, 68, 72, 77].
Исследовано влияние “Ралоксифена” (в рамках исследования MORE) на риск возникновения клинически значимых переломов тел позвонков. За 1 год в группе “Ралоксифена” по сравнению с плацебо отмечено уменьшение новых клинических переломов тел позвонков на 68% (р < 0,01) во всей популяции больных и на 66% (р < 0,01) у женщин с предшествующими переломами, у которых риск новых переломов выше. Не было различий в уменьшении риска клинических переломов на 1-, 2- и 3-м годах лечения. Таким образом, “Ралоксифен” оказывает влияние на снижение раннего риска клинических переломов тел позвонков, что сопоставимо с другими антирезорбтивными препаратами [21]. Изучено влияние “Ралоксифена” на риск переломов тел позвонков у женщин с остеопенией по сравнению с женщинами с остеопорозом (п = 3204) без предшествующих переломов тел позвонков. RR переломов позвонков по сравнению с плацебо у женщин с остеопенией составил 0,53, а при остеопорозе — 0,31. Риск клинических переломов тел позвонков у женщин с остеопенией под влиянием “Ралоксифена” по сравнению с плацебо снизился на 75% [20].
По сравнению с плацебо, “Ралоксифен” достоверно повышал МПК в поясничных позвонках и шейке бедра. При анализе изменения МПК в результате применения “Ралоксифена” и плацебо и риском новых переломов позвонков было выявлено, что независимо от изменений МПК за 1-й и 3-й годы лечения “Ралоксифеном” риск позвоночных переломов снижался на 38 и 41% соответственно. Основным механизмом действия “Ралоксифена” является преимущественное подавление костной резорбции [62, 66, 68, 72, 77]. По данным метаанализа, “Ралоксифен” достоверно повышает МПК по сравнению с плацебо на 1,33% для программы «Все тело», на 2,51% для поясничных позвонков, на 2,05% для общего показателя лучевой кости, на 2,11% для общего показателя бедренной кости (во и всех случаях р < 0,01). Отмечен более выраженный эффект “Ралоксифена” на МПК при увеличении длительности лечения, но не дозы препарата [13]. Таким образом, установлены существенная эффективность “Ралоксифена “по снижению риска переломов тел позвонков, умеренное повышение МПК во всех отделах скелета и антирезорбтивное действие на костную ткань.
Внескелетные эффекты “Ралоксифена”
При приеме “Ралоксифена” достоверно снижается уровень общего холестерина и холестерина липидов низкой плотности (ХЛНП) [72, 77, 81, 83]. Он не влияет на содержание в крови триглицеридов и холестерина липидов высокой плотности. Четырехлетние наблюдения за липидами в исследовании MORE показали тот же эффект [I].
При оценке действия “Ралоксифена” на риск сердечно-сосудистых заболеваний было обнаружено, что на их частоту в популяции в целом он не влияет. Однако у женщин с высоким риском сердечно-сосудистых заболеваний и лиц, перенесших или имеющих их, “Ралоксифе”н, в отличие от эстрогенов, достоверно снижает риск новых случаев заболеваний [59, 71].
В рамках исследования MORE было изучено влияние “Ралоксифена” по сравнению с плацебо на углеводный обмен и параметры кардиоваскулярного риска у 202 пациенток с сахарным диабетом II типа и у 1800 женщин без диабета. По сравнению с плацебо, “Ралоксифен” не влиял на уровень гликированного гемоглобина, достоверно снижал содержание ХЛНП, общего холестерина и фибриноген у женщин как с сахарным диабетом, так и без него [57].
“Ралоксифен” на 84% снижал частоту эстрогензависимого инвазивного рака молочных желез после 4-летнего применения у женщин в постменопаузе с остеопорозом, которые в популяции в целом имеют низкий риск развития рака молочных желез [67]. Необходимо пролечить “Ралоксифеном” 93 женщины в течение 4 лет, чтобы предотвратить 1 случай инвазивного рака молочных желез [67]. “Ралоксифен”, по сравнению с ЗГТ, оказывает больший эффект на плотность молочных желез. Проведен анализ результатов исследования MORE с точки зрения проверки гипотезы, что “Ралоксифен” снижает частоту рака молочной железы в большей степени у женщин с более высоким уровнем эстрадиола, чем с низким уровнем [61]. Тем не менее, для того чтобы рекомендовать “Ралоксифен” для профилактики рака молочной железы, необходимы проспективные исследования женщин с высоким риском этого заболевания.
Длительность терапии. К настоящему времени эффективность и безопасность “Ралоксифен”а определена для 4-летнего лечения, но имеются данные и по непрерывному применению в течение 5 лет.
Побочные эффекты. Пациентки, принимающие “Ралоксифен”, чаще, чем в группе плацебо, жаловались на приливы жара к лицу и судороги в ногах. Как правило, эти симптомы мягкие или умеренные и не требуют прекращения лечения. Не выявлено связи между судорогами в ногах и риском развития тромбоэмболии. [63, 64, 77, 83].
Серьезным побочным эффектом, связанным с приемом “Ралоксифена”, являются венозные тромбоэмболии. Достоверное повышение частоты тромбозов зарегистрировано только по результатам исследования MORE ввиду большого количества пациенток, включенных в это исследование.
Таким образом, “Ралоксифен” противопоказан пациенткам, в анамнезе которых имеются указания на венозные тромбозы или тромбоэмболии. Рекомендуется прекращать прием препарата за 3 дня до предполагаемой длительной иммобилизации (длительный перелет, госпитализация с оперативным вмешательством и пр.). Не рекомендуется применение “Ралоксифена” женщинам с частыми приливами.
О возможности комбинации “Ралоксифена “с другими антиостеопоротическими препаратами данные весьма скудные. Сочетание “Ралоксифена” как с антирезорбтивными препаратами, так и со стимуляторами остеогенеза может дать положительный эффект, но этот вопрос требует дальнейшего изучения. Ограничением к широкому применению комбинированной терапии является высокая стоимость такого лечения.
Выводы (уровень доказательности А):
- “Ралоксифен “эффективен для предотвращения переломов тел позвонков у женщин с постменопаузальным остеопорозом.
- “Ралоксифен” повышает МПК в позвонках и проксимальных отделах бедренной кости.
- К настоящему времени не доказана эффективность “Ралоксифена” в профилактике внепозвоночных переломов.
- “Ралоксифен” снижает частоту возникновения эстрогензависимого инвазивного рака молочной железы у женщин с постменопаузальным остеопорозом.
- “Ралоксифен” увеличивает риск венозных тромбоэмболиий.
- Комбинация “Ралоксифена” и “Алендроната” у женщин в постменопаузе в большей степени, чем монотерапия, увеличивает МПК в поясничном отделе позвоночника и шейке бедра. Нет данных о снижении риска переломов.
- “Ралоксифен” является препаратом первой линии для профилактики остеопороза позвоночника и шейки бедра, однако нет данных о снижении риска переломов.
- “Ралоксифен” является препаратом второй линии для лечения постменопаузального остеопороза.
Паратиреоидный гормон (ПТГ)
Терипаратид — это N-терминальный фрагмент (1—34 аминокислотные последовательности) ПТГ человека, обладающий биологической активностью. В опытах на животных было показано, что интермиттирующие дозы терипаратида стимулируют преимущественно костеобразование, а не костную резорбцию за счет увеличения количества и активности остеобластов [4].
ПТГ для лечения постменопаузального остеопороза.
В многоцентровом рандомизированном двойном слепом плацебо контролируемом исследовании с участием 220 пациентов было показано дозозависимое (50, 100, 200 ЕД) увеличение МПК различных отделов скелета, за исключением костей запястья, через 48 нед. лечения терипаратидом.
Наибольшей статистической достоверностью обладает исследование R. Neer и соавт. (2001), в котором показано влияние терипаратида на снижение частоты переломов позвоночника и внепозвоночных переломов у 1637 женщин как минимум с одним переломом в анамнезе. Женщины были рандомизированы на группы: 544 получали плацебо, 541 — 20 мкг терипаратида и И 552 — 40 мкг терипаратида в сутки. Все пациенты принимали препараты кальция (1000 мг/сут.) и витамина D (400—1200 ЕД/сут.). Продолжительность лечения 18 мес. При этом наилучший результат отмечен при лечении остеопороза у мужчин, особенно в возрасте старше 70 лет. ПТГ также показан для лечения глюкокортикоидного остеопороза. Рекомендуется как препарат для лечения тяжелых форм остеопороза у женщин в постменопаузе, особенно при плохой переносимости бисфосфонатов. Паратиреоидный гормон (ПТГ) – терипаратид. Увеличивает количество и активность остеобластов, стимулирует преимущественно костеобразование.
ПТГ используют для лечения постменопаузального остеопороза, для лечения остеопороза у мужчин и глюкокортикоидного остеопороза. Как правило, ПТГ применяют одновременно с препаратами Са, витамином D.
Заместительная гормональная терапия (ЗГТ) – не только предотвращает потери МПК, но и увеличивает МПК у 95% женщин в постменопаузе (Rejnmark et al. 2004). Этот вопрос достаточно хорошо освещен в литературе. Большинство исследователей указывает на необходимость своевременного назначения ЗГТ в течение первого года после наступления менопаузы. ЗГТ, назначенная в более поздние сроки, менее эффективна. Хорошо комбинировать ЗГТ с остеопротекторами первого ряда.
Препараты кальция
Кальций (Са) – микроэлемент, который содержится в организме в количествах, больших, чем многие другие ионы. Он входит в число пяти наиболее важных биогенных элементов. В организме взрослого человека в среднем содержится около 1 кг Са, из которого 99% – в скелете. Костная ткань не является инертной, между нею и тканевой жидкостью постоянно происходит обмен Са. Кальций выполняет несколько важнейших функций в организме, поэтому его концентрация в крови поддерживается на постоянном уровне в довольно узком диапазоне значений. Физиологической активностью обладает ионизированный Са.
Функции кальция в организме
- Структурная – кости, зубы
- Нейромышечная
– контроль возбудимости;
– освобождение медиаторов;
– контроль деятельности мышц. - Ферментативная:
– кофактор компонентов гемостаза, метаболизм гликогена. - Регуляторная
– внутриклеточный мессенджер, секреция гормонов.
Кальций поступает в организм с пищей, всасывается в кровь в кишечнике. Часть его выделяется с каловыми массами. В почках Са практически полностью реабсорбируется, его экскреция невелика и зависит от уровня Са в организме. Регулируется обмен Са в организме следующими факторами. Паратгормон мобилизует кальций из костей, повышает его всасывание из кишечника и стимулирует канальцевую реабсорбцию. Синергистом по отношению к ПГ выступает витамин D. Оба эти вещества определяют повышение уровня Са в крови. Противоположным эффектом обладает гормон паращитовидной железы кальцитонин.
В организме Са существует в свободной форме, связанной с протеинами, комплексированной с анионами (лактат, бикарбонат, цитрат и др.), что имеет принципиально важное значение в определении кальция и интерпретации изменений его уровня.
Нарушения обмена Са затрагивают прежде всего костную ткань. При нарушении регуляции его накопления или выведения могут возникнуть две ситуации: негативный баланс (остеопороз, остеомаляция) и позитивный (остеосклероз).
В среднем взрослый человек должен потреблять в сутки около 1 г Са, хотя для постоянного возобновления структуры тканей требуется лишь 0,5 г. Это связано с тем, что ионы Са усваиваются (всасываются в кишечнике) лишь на 50%, т.к. образуются плохо растворимые соединения. Растущему организму, беременным и кормящим женщинам, людям с повышенной физической и эмоциональной нагрузкой, а также людям, прикованным к постели, требуется повышенное количество Са – примерно 1,4 – 2 г в сутки. В зимний период Са требуется больше.
Таблица 25
| Возраст и контингент | Количество кальция |
| Дети:. | |
| до 6 мес. | 400 |
| до 1 года | 600 |
| 1-10 лет | 800 |
| 11-18 лет | 1500 |
| Взрослые: | |
| 18-50 лет | 800-1000 |
| Мужчины после 70 лет | 1200 |
| Беременные и кормящие | 1200 |
| Женщины в период менопаузы: | |
| Получающие эстрагены | 1000 |
| Получающие витамин D | 800 |
| Не получающие данные препараты | 1500 |
Какой Са лучше принимать?
Если применять лактат, глицерофосфат или глюконат Са, то не стоит рассчитывать даже на минимальный положительный эффект. Всасывание из них Са минимальное и составляет от 9 до 13%. Между прочим, глицерофосфат уже запрещен в ветеринарии, но до сих пор продается в аптеках и часто назначается педиатрами детям.
Са можно и нужно применять при обязательном соблюдении определенных правил. Важно обращать внимание на соотношение Са и витамина D, правильное соотношение Са и Mg – 2:1. Оттого, насколько грамотно будут соблюдены эти правила, зависит и положительный эффект от проводимой терапии.
Необходимо помнить, что Са хорошо усваивается организмом только из продуктов, не подвергающихся тепловой обработке. При термической обработке органический Са мгновенно переходит в неорганическое состояние и практически не усваивается организмом.
В мире широко используются БАД, являющиеся оптимальной формой применения Са как в профилактических, так и в лечебных целях. Наиболее эффективными являются комплексные БАД, в состав которых входят все необходимые микроэлементы и витамины в сбалансированном количестве. Во всех БАД, представляемых программой «NP 2000», Са с Mg сбалансированы оптимально.
Факторы, влияющие на усвоение Са организмом
Необходимо Са принимать вместе с белковой пищей, с аминокислотами (т.к. транспортерами Са в клетку являются аминокислоты).
Препараты Са следует запивать ½ – 1 стаканом воды. Хорошо добавить 1 столовую ложку лимонного сока, что повышает усвоение солей Са. Это особенно важно людям с пониженной кислотностью желудочного сока, которая снижается с возрастом и при различных заболеваниях. Необходимо следить за достаточным питьевым режимом: не менее 1,5 литра жидкости в день (максимум до 14 часов с учетом биоритма почек). При запорах количество жидкости должно увеличиваться.
Желчные кислоты также способствуют усвоению Са. При различных заболеваниях желчного пузыря, связанных со снижением его функции, прием Са следует сочетать с приемом желчегонных средств.
Витамин D и гормоны паращитовидных желез способствует всасыванию Са в кишечнике и отложению Са и Р в костях.
Для усвоения Са требуются такие витамины, как А, С, Е, и микроэлементы – магний, медь, цинк, селен, причем в строго сбалансированном виде.
Соблюдение Ca-Mg равновесия играет большую роль в Са-Р обмене. Мg является антагонистом Са в обменных процессах. При избытке Mg увеличивается выведение Са из организма, т.е. Mg начинает вытеснять Са из тканей и костей, что ведет к нарушению нормального костеобразования. Однако при дефиците Mg также нарушаются процессы образования костей. Нормальное формирование костной ткани возможно лишь при полноценном синтезе коллагена. Коллаген является своеобразной арматурой для Са. Дефицит Mg приводит к нарушению синтеза коллагена, что в итоге ведет к нарушению нормального костеобразования. В пище, как правило, не хватает Mg, поэтому его следует вводить дополнительно в соотношении Ca:Mg = 2:1.
Оптимальное соотношение поступления в организм Са с фосфором – 2:1. Но часто имеет место нарушение Са/Р обмена. Это связано с тем, что в рационе в среднем содержание Р в 7-10 раз больше, чем этого требует организм. Избыток Р не позволяет усваиваться Са и тем самым может вызывать низкое его содержание. Лекарственные препараты, содержащие алюминий, выводящие избыток Р из организма, высокотоксичны. Наиболее эффективно применение гомеопатического Р, действие которого направлено на выведение избытка Р из организма. Целесообразно давать Р в 12-кратном разведении 1 раз в сутки или в 30-кратном разведении 1 раз в неделю за 20 минут до еды или через 40 минут после еды вечером перед сном в течение 6 месяцев.
Повышенное всасывание Са происходит при употреблении избыточного количества кислотообразующих веществ и биостимуляторов – элеутерококка, женьшеня, лимонника, газированных напитков.
Заболевания, требующие назначения Са, в связи с его дефицитом:
- заболевания центральной нервной системы;
- онкологические заболевания;
- рахит;
- гипотрофия;
- заболевания суставов (артриты, остеопороз и др.);
- заболевания ЖКТ (острый панкреатит (при дефиците Са нарушается выработка ферментов поджелудочной железы), гастрит, язвенная болезнь, с-м мальабсорбции или нарушенного кишечного всасывания, дискинезия желчевыводящих путей, желчекаменная болезнь и др.);
- сердечно-сосудистые заболевания (атеросклероз, ИБС, ИМ, инсульт, артериальная гипертония, нарушения ритма и проводимости);
- ревматические заболевания (установлено, что у детей дефицит Са отмечается уже в самом начале заболевания);
- хронические заболевания почек, почечная недостаточность;
- дерматологические заболевания (псориаз, атонический дерматит, аллергические реакции) – в основе лечебного эффекта – ощелачивание организма;
- эндокринная патология (гипопаратиреоз, сахарный диабет 1 типа и др.);
- муковисцидоз;
- хронические легочные заболевания (установлено, что при повышенной бронхиальной секреции отмечается потеря Са);
- анемия (всегда сопровождается дефицитом Са, что ведет к дефициту железа, поэтому при онкологии, при СТД, при заболеваниях ЖКТ – анемия – из-за дефицита Са);
- дисплазия («слабость») соединительной ткани (миопия, пролапс митрального клапана, ортопедическая патология – плоскостопие, сколиоз, деформация грудной клетки).
Состояния, требующие назначения Са, в связи с его повышенными затратами организмом:
- занятия спортом, повышенные физические нагрузки;
- беременность, кормление грудью;
- менопауза;
- периоды бурного роста у детей и подростков;
- стресс;
- иммобилизация;
- зимний период;
- предоперационный и послеоперационный период.
Имеются факты, что у людей с признаками соединительно-тканной дисплазии послеоперационный период чаще осложняется нарушениями сердечного ритма. Таким образом, пациенты с дефицитом Са представляют группу риска по развитию жизнеугрожаемых аритмий в операционный и послеоперационный период.
Избыточное потребление поваренной соли стимулирует потери кальция с мочой и усиливает нарушения кальциевого обмена, которые в свою очередь способствуют развитию чувствительности к хлориду натрия. Доказано, что препараты кальция, не обладая прямым гипотензивным действием, снижают чувствительность к поваренной соли у больных эссенциальной гипертензией.
С учетом того, что в настоящее время остеопороз рассматривается как кальципеническое состояние, то адекватным подходом к предотвращению раннего развития и быстрого прогрессирования остеопороза является его профилактика, важным компонентом которой является обеспечение достаточного поступления Са и витамина D в организм.
Кальций – наиболее распространенное вещество для профилактики и лечения остеопороза. Он необходим для минерализации костей, способствует достоверному увеличению пиковой массы костной ткани, обладает определенным антирезорбтивным потенциалом, способствуя увеличению уровня ионизированного кальция. Регулярный длительный прием препаратов кальция в достаточной дозе не только тормозит костную резорбцию, но и снижает риск переломов костей. С точки зрения доказательной медицины препараты Са являются эффективными средствами в профилактике переломов костей.
Установлено, однако, что могут быть отрицательные результаты. Обычно в тех случаях, в которых монотерапия препаратами кальция проводилась у женщин в течение первых 5 лет после начала менопаузы. У женщин более пожилого возраста (6 лет и более после менопаузы) и у лиц с исходно низким потреблением кальция (менее 400 мг/сут.) лечение препаратами кальция было, как правило, более эффективным. Немаловажное значение имеет и выбор препаратов кальция, поскольку различные лекарственные формы существенно различаются по содержанию элементарного кальция, биологической доступности и влиянию на костный обмен. Например, всасывание карбоната кальция уменьшается при снижении желудочной секреции у пожилых больных и на фоне лечения блокаторами Н2-гистаминовых рецепторов. Напротив, всасывание цитрата кальция менее зависит от состояния желудочной секреции, а его биологическая доступность выше, чем карбоната кальция. Кроме того, цитрат кальция, в отличие от карбоната кальция, подавляет секрецию ПТГ, следовательно, обладает более высоким антирезорбтивным потенциалом.
Основной источник кальция для организма – молоко и молочные продукты.
Ориентировочный расчет дозы кальция, полученного с молоком, проводим по формуле:
V = 300 мг х N, где 300 – количество мг Са в 1 бокале молока, N – количество бокалов молока, выпитого пациентом за сутки. В таблице 26 представлена схема расчета потребления Са.
Таблица 26
| Продукт | Количество продукта съедено |
Содержание Са мг в единице продукта |
Получено Са |
| Молоко (бокал 240 мл) | 0,5 бокала Х | = 300 мг | = 150 мг |
| Йогурт (240 мл) | 0,5 бокала Х | = 400 мг | = 200 мг |
| Сыр кубик 2,5 х 2,5 см | 0,5 кубика | = 200 мг | = 100 мг |
| итого | 450 мг |
Такого количества Са для пожилых явно недостаточно. Ассоциация по остеопорозу рекомендует пожилым лицам до 1200 мг Са в день. Недостающее количество 1200 мг – 450 мг = 850 мг можно покрыть карбонатом Са, цитратом кальция и т.д. При большем содержании Са в диете (1200 – 1500 мг) существует риск камнеобразования в почках.
Для улучшения абсорбции прием препаратов кальция не следует сочетать с приемом пищевых продуктов и слабительных препаратов, которые подавляют абсорбцию кальция. До недавнего времени считалось, что кальций лучше принимать порциями в течение всего дня в разовой дозе не более 600 мг. Однако недавно появились сообщения, что вечерний прием кальция предпочтительней, так как позволяет подавить циркадное усиление костной резорбции в ночное время. На фоне приема кальция необходимо принимать больше жидкости. Следует иметь в виду определенный риск развития мочекаменной болезни, особенно при приеме высокой дозы препарата (более 2000 мг/сут.). Поэтому у лиц с семейным анамнезом нефролитиаза лечение препаратами кальция должно проводиться с особой осторожностью. В этом случае лучше использование цитрата кальция, прием которого снижает риск образования камней в почках. При развитии запоров следует увеличить потребление жидкости, растительных продуктов с большим содержанием клетчатки или заменить препарат кальция.
Прием кальция (1000-1500 мг/сут.) в сочетании с витамином D (400-800 МЕ/сут.) следует рекомендовать всем женщинам после менопаузы, но особенно лицам пожилого возраста с низкой абсорбцией кальция в желудочно-кишечном тракте (ЖКТ) и сниженной мочевой экскрецией кальция (<100 мг/сут.). Аналогичная тактика и в отношении использования кальция и витамина D для профилактики ГК – индуцированного остеопороза [3, 31, 39].
Тактика ведения пациентов, получающих терапию препаратами кальция с учетом его суточной экскреции, дана в таблице 7. Тест рекомендуется проводить через три месяца после начала терапии кальцием.
Витамин D играет очень важную роль в регуляции кальциевого гомеостаза. У лиц пожилого возраста и больных, лечебных глюкокортикоидами (ГК), наблюдается снижение кишечной абсорбции кальция. Недостаточность витамина D является одной из основных причин нарушения костного обмена и потери костной ткани у лиц пожилого возраста. Лечение витамином D женщин в позднем периоде менопаузы приводит к достоверному уменьшению потери костной массы в шейке бедра. Более того, имеются данные о благоприятном эффекте приема витамина D в отношении переломов костей. По данным 18-месячного исследования, в которое были включены 3270 здоровых женщин пожилого возраста (средний возраст 84 года), частота переломов на 32% ниже у женщин, принимавших кальций (1,2 г/сут.) и витамин D3 (20 мкг), чем в контрольной группе, получившей плацебо. M. Chapuy и соавт. представили результаты 36 -месячного наблюдения за той же группой больных. В основной группе, по сравнению с контрольной, вероятность переломов шейки бедра снизилась на 29% и невертебральных переломов – на 24%. По данным R.Heikinheimo и соавт., ежегодное внутримышечное введение витамина D (150000-300000 МЕ) приводит к снижению частоты переломов верхних конечностей у лиц пожилого возраста.
Существуют некоторые общие рекомендации, касающиеся применения препаратов кальция и витамина D для профилактики остеопороза. Кальциферолы хорошо растворимы во всех органических растворителях: спирте, жирах, растительных маслах. Смешивание концентрированных растворов витамина D с сухими наполнителями (CaCO3, каолин, СаНСО3 и др.) при получении сложных лекарственных форм снижает стабильность препарата; быстрое разрушение связано с его окислением, которое ускоряется из-за увеличения поверхности соприкосновения с воздухом. Кристаллический витамин D в смеси с порошкообразными веществами— тальком, каолином, лактозой и другими — также довольно быстро теряет антирахитическую активность. При этом витамин D не окисляется, а изомеризуется.
Наиболее устойчивыми препаратами витамина D являются его различные эфиры с органическими кислотами (нитробензоаты, ацетат и др.). Путем омыления эфиров получают чистый кристаллический эргокальциферол, который в темных запаянных ампулах может в течение нескольких лет сохранять свои физико-химические свойства. При исследовании различных стабильных препаратов витамина D было выявлено, что они неустойчивы и легко разрушаются при воздействии кислорода воздуха и света с утратой антирахитических свойств. Даже при хранении в холодильнике при доступе воздуха этот препарат сохраняется лишь 1—2 мес.
Таким образом, препараты витамина D и рыбий жир необходимо хранить в условиях, исключающих действие света и воздуха, приводящих к их инактивации. Кислород воздуха окисляет витамин D, а свет превращает его в ядовитый токсистерин. В связи с этим витамин D и его препараты хранят с предосторожностью (список Б). Драже эргокальциферола содержат в сухом, защищенном от света месте, спиртовой и масляный растворы — в доверху заполненных, хорошо упакованных склянках оранжевого стекла, в защищенном от света месте, при температуре не выше 10°С.
Активные метаболиты витамина D. Несмотря на положительные результаты применения кальция для профилактики остеопороза и его осложнений, монотерапия этими препаратами все же во многих случаях недостаточно эффективно уменьшает потерю костной массы. В связи с этим одно из перспективных предложений в профилактике и лечении остеопороза связано с использованием активных метаболитов витамина D. В настоящее время в клинической практике применяется два синтетически активных аналога витамина D – кальцитриол и альфакальцидол (“Альфа D3 Тева”). Кальцитриол идентичен наиболее активному метаболиту витамина 1,25(ОН)2D3, который образуется в почках и является конечным продуктом метаболизма витамина D. Альфакальцидол – биохимический предшественник кальцитриола, который в организме человека трансформируется в печении и костях в 1,25(ОН)2D3.
Метаболитам витамина D свойствен широкий спектр системных гормоноподобных эффектов, выходящих за рамки регуляции метаболизма костной ткани. Действия их многообразны и связаны с воздействием как на функциональную активность остеокластов и остеобластов (ОБ), так и мышечную ткань, ЦНС, систему иммунитета. Рецепторы для 1,25(ОН)2D3 экспрессируется на ОБ, а также на многих других клетках, включая энтероциты, клетки дистальной части почечных канальцев, паращитовидной железы, поджелудочной железы, активированные лимфоциты и др. Выявлен анаболический эффект 1,25(ОН)2D3, который реализуется за счет активации генов, регулирующих синтез факторов роста, стимулирующих функцию ОБ. Эффекты активных метаболитов витамина D следующие:
- подавление костной резорбции,
- усиление абсорбции кальция в ЖКТ,
- подавление пролиферации паратиреоидных клеток.
- улучшение качества кости:
- подавление перфорации трабекулярных пластинок,
- усиление репарации костей,
- усиление синтеза костного матрикса,
- усиление синтеза факторов роста.
Другие эффекты:
- увеличение мышечной силы,
- увеличение подвижности суставов,
- улучшение нервно-мышечной проводимости,
- подавление синтеза цитокинов (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-12 и др.)
Чем меньше возраст, тем более эффективен витамин D и его активные метаболиты в лечении и профилактике остеопенических состояний.
Однако важно помнить, что при неправильном применении витамина D могут быть осложнения в виде гипервитаминоза D.
Гипервитаминоз D и гиперкальциемия
При длительном лечении эргокальциферолом или холекальциферолом гиперкальциемия обычно обусловлена накоплением 25(ОН)Dз, что может быть вызвано одновременным избыточным потреблением пищевых продуктов, содержащих много кальция, например, молочных продуктов. Гипервитаминоз D описан даже при употреблении молочных продуктов, обогащенных витамином D. При гипервитаминозе D уровень 25(ОН)Dз в сыворотке может в 5-10 раз превышать норму, а уровень 1,25(ОН)2Dз обычно нормальный или слегка повышен. Гиперкальциемия и гиперкальциурия возникают вследствие действия 25(ОН)Dз на рецепторы витамина D в тонкой кишке и, возможно, в костной ткани. Из-за накопления 25(ОН)Dз в мышцах и жировой ткани и медленного его высвобождения высокий уровень 25(ОН)Dз в сыворотке и проявления гипервитаминоза сохраняются на протяжении недель и месяцев после прекращения приема витамина D.
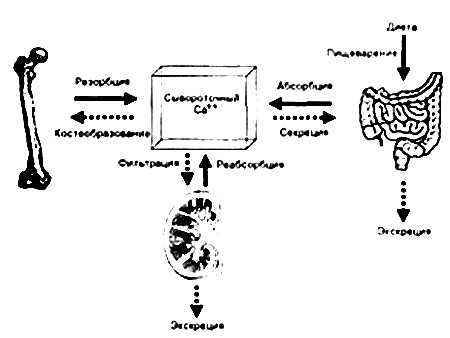
Рис.23. Основные патогеетические механизмы развития гиперкальциемии
Риск гиперкальциемии повышен при приеме препаратов, более активных, чем эргокальциферол и холекальциферол. К ним относятся кальцифедиол, кальцитриол и синтетические препараты дигидротахистерол и альфакальцидол. В печени дигидротахистерол и альфакальцидол превращаются в гормонально активные вещества – 25(ОН)Dз дигидротахистерол и 1,25(ОН)2D3 соответственно. Поскольку все перечисленные препараты метаболизируются быстро, продолжительность гиперкальциемии после прекращения их приема меньше, чем после прекращения приема эргокальциферола и холекальциферола.
Нами обследовано более 1000 пациентов, получавших длительно (от года до 3 и более лет) препараты витамина D по поводу остеопороза. Из них у 86 чел. была выявлена гиперминерализация I–III степеней тяжести. Однако клинические проявления D-витаминной интоксикации достоверно были выявлены только у 9 пациентов (снижение аппетита, полидипсия, учащенные мочеиспускания), гиперкальциемия, гиперкальциурия, резко положительная проба Сулковича).
Лечение. Отмена препаратов витамина D и ограничение потребления кальция с пищей. При тяжелой гиперкальциемии главным препаратом является кальцитонин, на несколько дней или недель назначают глюкокортикоиды, например, “Преднизон” внутрь или в/в. (см. таблицу 27). Кортикостероиды блокируют действие витамина D на тонкую кишку и кости.
Таблица 27
| ЛЕЧЕНИЕ | ДОЗА | СПОСОБ ВВЕДЕНИЯ | КОНТРОЛЬ/ПРИМЕЧАНИЕ |
| Кальцитонин лосося | 4-8 МЕ/кг каждые 6-12 часов | в/м или п/к | М.б. аллергическая реакция. Перед лечением проведите пробу с введением 1 ME внутрикожно |
| Преднизон/метилпред-Низолон | 20 мг 2-3 раза в день | внутрь или в/в | Эффективен при гиперкальциемии, связанной с 1,25-дигидроксивитамином D |
| Нейтральный фосфат | 500-1000 мг 3 раза в день | внутрь | Как вспомогательное средство к другой терапии. Избегайте, если уровень PO4 в сыворотке > 3,5 мг/дл |
| Диализ | Диализат с низким содержанием кальция или без кальция | ГД/ПД НАВГД | Гиперкальциемический криз. Рефрактерная гиперкальциемия. При почечной недостаточности – консультация нефролога |
| Изотонический раствор NaCI 0,9% | 250-1000 мл/ч | в/в | При токсикозе. Исследованием ЦВД/ДЗЛК, Ro-графия грудной клетки |
| Фуросемид | 20-80 г каждые 2-4 часа или 40 мг/ч | НВ в/в | Восполнитель К+, Мg2+ и PO4 – на основе сывороточных концентраций и потерь с мочой |
В связи с изложенным при длительном применении витамина D и его метаболитов необходим контроль. Обратите внимание на то, что симптомы гипо – и гиперкальциемии очень похожи, что может быть причиной неверной диагностики и назначения не адекватной терапии. Это еще раз указывает на то, что оба состояния отражают общую проблему нарушения Са/Р обмена со снижением Са в костях и на клеточном уровне. В диагностике нарушений Са/Р обмена имеет значение определение содержания внутриклеточного и ионизированного Са.
Тактика ведения пациентов, получающих терапию препаратами витамина D и его активными метаболитами:
- контроль Са, Р, креатинина в крови – 1 раз в 3 мес.;
- контроль трансаминаз и щелочной фосфатазы – 1 раз в 4-6 мес.
Большую помощь в диагностике нарушения Са/Р обмена оказывает ЭКГ.
ЭКГ-критерии гипокальциемии:
- удлинение интервала QT;
- расширение QRS комплекса;
- удлинение сегмента ST.
ЭКГ-критерии гиперкальциемии:
- укорочение QRS комплекса;
- укорочение интервала QT;
- удлинение интервала PQ до развития АВ – блокад различной степени;
- снижение или инверсия Т в V2, V3;
- увеличение амплитуды U-волны.
Основные рекомендации по ведению остеопороза у женщин постменопаузального возраста и мужчин старше 50 лет:
- Установить факторы риска остеопороза и возможность костных переломов.
- Выявить две основные причины (фактора риска) остеопороза.
- Рекомендовать кальций не менее 1200 мг в день, включая добавки и витамин D (800–1000МЕ) для лиц старше 50 лет.
- Рекомендовать упражнения, включающие поднятие тяжестей, для укрепления мышц, для снижения риска падений.
- Исключить курение, снизить избыточное употребление алкоголя и алкогольсодержащих напитков.
- Женщинам в постменопаузальном периоде и мужчинам 50–69 лет рекомендуется измерение BMD, если имеются факторы риска переломов.
- Рекомендуется определение BMD лицам, имевшим переломы, что необходимо для определения степени тяжести заболевания.
- Начать лечение в первую очередь тем пациентам, у кого имеется перелом шейки бедра и тел позвонков.
- Начать лечение тем, у кого ВМД по T-score = или <2,5 С0 в шейке бедра или в позвоночнике.
Необходимо приступать к лечению женщин постменопаузного возраста и мужчин 50 лет и старше, если минеральная плотности костной ткани понижена (по T-score от -1 до -2,5 СО в шейке бедра или тел позвонков); если 10-летний риск перелома шейки бедра составляет более 3% или по специальной шкале (ФРАКС) более 20%).
Современное лечение апробировано FRAX fnd NOF федеральным управлением по лекарственным препаратам при правительстве США. Рекомендован ограниченный круг препаратов для лечения остеопороза: бисфосфонаты (alendronate, ibandronate, risedronate and zoledronic acid), calcytonin, заместительная гормональная терапия, паратиреоидный гормон и “Ралоксифин”, витамин D и его активные метаболиты, препараты кальция).
Приветствуется схема лечения по Frost (1981), направленная на селективное управление активности остеобластов и остеокластов, на восстановление баланса между резорбцией и новообразованием костного вещества. При этом в процессе новообразования кости выделяется 4 периода:
1 этап – активация остеокластов. А – период.
2 этап – депрессия остеокластов. D – период.
3 этап – свободный от приема препарата. F – период.
4 этап – повторение терапии. R – период.
Продолжительность A и D этапов составляет от 1 до 4 недель, F период – 2-3 месяца. Общая продолжительность АDFR-терапии составляет от 2-3 лет и более.
Определение эффективности лечения проводят в центрах остеометрии. Лиц, получающих лечение, сканируют спустя 2 года с последующим контролем каждые два года. При необходимости остеометрию можно проводить чаще (1 раз в 10-12 мес.).
Рекомендации для пациентов по молоку, витамину D и кальцию
Рекомендации для населения должны включать в себя оптимальный прием кальция и витамина D, пожизненные занятия физическими нагрузками, включающими силовые упражнения, воздержание от курения, выявление и лечение алкоголизма и модификация других факторов риска переломов, таких как, например, нарушение зрения.
Нормы потребления кальция и витамина D
Контролируемыми исследованиями показано, что прием препаратов кальция и витамина D снижают риск переломов. Суточное количество кальция, включая добавки, должно составлять 1200 мг день. Пожизненное употребление кальция необходимо для достижения пика костной массы и последующего поддержания здоровья кости. В скелете содержится 99% всего кальция всего организма. Когда снижается поступление кальция из вне, костная ткань подвергается резорбции для поддержания достаточного уровня кальция в сыворотке крови. NOF (Национальная ассоциация остеопороза) поддержал рекомендации National Аcademy of Sciences (NAS), что женщины старше 50 лет должны получать 1200 мг элементарного кальция. Не доказано преимущество более высоких доз кальция (1200-1500 мг/день) в профилактике переломов. Кроме того, прием таких доз может способствовать образованию камней в почках и ухудшает состояние сердечно-сосудистых заболеваний.
Во многих странах Европы и Америке потребность в кальции покрывают за счет молока. В Китае КПК принята программа – каждому гражданину 1 литр натурального молока. Безопасности молочного питания уделяется большое внимание. В Китае молоко – это стратегический ресурс. В таблице 28 приведена простая методика расчета содержания кальция в диете пациента. В нашей стране зависимость от экспорта молочных продуктов не решена. Особенно это касается молочного питания детей первого года и первых лет жизни. Важно наладить производство натурального молока в каждом регионе нашей страны, что обеспечит население этим ценным продуктом, реально снизит заболеваемость остеопорозом и частоту костных переломов. Экономический эффект при этом составит астрономические цифры, повысит стратегический и оборонный потенциал страны.
Зачем необходим витамин D? Пациент должен знать, что витамин D играет главную роль в абсорбции кальция, нормальной минерализации костей, мышечного тонуса и равновесии, предупреждении падений. Доза витамина D для женщин в возрасте старше 50 лет должна составлять от 800 до 1000 МЕ в день. Такая доза витамина поддерживает концентрацию 25(ОН)D в сыворотке крови на достаточном уровне (75 nmol/L) или выше. Главными продуктовыми источниками витамина D являются молоко, обогащенное витамином D (400 МЕ/литр), желток, морская рыба и печень. Некоторые кальциевые препараты и поливитамины также содержат витамин D.
В группу риска по недостатку витамина D включают пожилых пациентов с мальабсорбцией (целиакией) и ХПН, пациентов, сидящие дома, больных с хроническими заболеваниями и лица с недостаточным пребыванием на солнце. У этих пациентов необходимо измерить 25(ОН) вит. D в сыворотке крови для установления дефицита витамина D. При недостаточном уровне витамина D в сыворотке крови необходимо добавлять витамин D в рацион до уровень 25(ОН) D в сыворотке крови выше 75 nmol/L. Отдельные пациенты (с мальабсорбцией и др.) могут получать витамин D в более высоких дозах до 2000 МЕ и даже выше.
Немедикаментозные способы лечения являются обязательной составной частью профилактики больного остеопорозом. Они включают образовательные программы, отказ от вредных привычек, физические упражнения и другую физическую нагрузку, по показаниям — ношение протекторов бедра. Силовые тренировки, аэробика, упражнения из исходного положения стоя и упражнения при ходьбе (за исключением прыжков) должны быть частью профилактики и лечения остеопороза. Все программы физической активности должны разрабатываться индивидуально с учетом возраста, диагноза, сопутствующих заболеваний и состояния пациента.
Регулярные ЛФК и упражнения с нагрузкой снижают риск падений и переломов. Помимо укрепления мышц, упражнения улучшают мышцы и костный аппарат, осанку, равновесие и координацию. Работают против гравитации при опоре тела на нижние конечности – включают ходьбу, бег, УШУ, ходьбу по лестницам, танцы и теннис. Мышечные упражнения включают работу на снарядах. Прежде чем приступить к программе упражнений, пациент с остеопорозом должен пройти соответствующее клиническое обследование, образование в школе по остеопорозу. Национальная ассоциация остеопороза настоятельно рекомендует физические нагрузки на протяжении всей жизни как для профилактики остеопороза, так и для улучшения общего состояния здоровья. Следует помнить, что с прекращением занятий эти преимущества теряются.
Профилактика переломов. Основные факторы риска переломов приведены в таблице 2.
В дополнении к поддержанию адекватных количеств витамина и физической активности, приведенных выше, необходимо обследовать остроту зрения и слуха, провести неврологическое обследование, если имеется неврологическая патология, рассмотреть лекарственную терапию на наличие побочных эффектов, влияющих на равновесие. Также необходимо снабдить пациентов памяткой по обеспечению безопасного быта. Ношение нижнего белья со вставленными протекторами может помочь предотвратить травму шейки бедра при падении. Применение протекторов шейки бедра может быть рассмотрено для тех пациентов, у которых имеется высокий риск переломов или у кого уже был перелом шейки бедра.
Курение и прием алкоголя
Всем курящим пациентам необходимо напоминать о необходимости прекратить курение. Курение негативно влияет как на состояние костного скелета, так и на здоровье в целом. Национальная ассоциация остеопороза настоятельно рекомендует прекращение курения в качестве одной из мер для предотвращения остеопороза.
Необходимо также распознавать и лечить пациентов с избыточным употреблением алкоголя. Считается, что умеренный прием алкоголя не наносит вред состоянию костной ткани, а также, по некоторым данным, снижает риск перелома у постменопаузальных женщин. Однако употребление более 3 условных доз алкоголя (одна условная доза алкоголя составляет: 44 мл крепких напитков – водка, коньяк, ром, бренди, 150 мл вина и 350 мл пива) вредно для организма. В Российских рекомендациях (2005 г.) утверждаемтся, что алкоголь – это яд даже в малых дозах. Алкоголь не является полезным продуктом в любом количестве.
- Актуальные проблемы остеопороза. Монография
- Актуальные проблемы остеопороза. Список сокращений
- Актуальные проблемы остеопороза. Монография В.И. Струкова. Введение
- Актуальные проблемы остеопороза. Часть I. Физиология костной ткани и патфизиология костных переломов. В. И. Струков
- Актуальные проблемы остеопороза. Часть II. Факторы риска остеопороза. В.И. Струков
- Актуальные проблемы остеопороза. Часть II. Факторы риска остеопороза. В.И. Струков
- Актуальные проблемы остеопороза. Часть III. Классификация остеопороза. Клинические варианты остеопороза, определение. В.И. Струков
- Актуальные проблемы остеопороза. Часть IV. Вторичный остеопороз
- Актуальные проблемы остеопороза. Часть V. Диагностика остеопороза
- Актуальные проблемы остеопороза. Часть VI. Остеопения и остеопороз у детей и подростков
- Актуальные проблемы остеопороза. Часть VII. Профилактика и лечение остеопороза
- Актуальные проблемы остеопороза. Заключение





