Данная монография о проблемах остеопороза вышла в свет в 2009 году. Пензенский профессор Виллорий Струков более полувека исследовал больных остеопорозом и изложил в работе свои взгляды на поистине мировую проблему потери человеком костной массы, перечислил методы лечения остеопороза, известные миру препараты. Эта работа была написана до того, как компания «Парафарм» выпустила препарат «Остеомед», который совместно разработали ученые — профессор В.И. Струков и физиолог В.Н. Трифонов.
Виллорий Иванович — постоянный участник и лектор всемирных конгрессов по костным заболеваниям. В своей врачебной практике он использовал различные способы лечения остеопороза и переломов, в том числе импортными препаратами — к примеру, американским «Цитракалом». Тем не менее, сегодня профессор Струков говорит о том, что «Остеомед» превзошел его ожидания, так как при его приеме скорость восстановления костной ткани гораздо выше импортных препаратов. А чем быстрее реабилитация человека, тем выше вероятность предотвратить повторный перелом.
С 2009 года Виллорий Иванович начал применять в своей врачебной практике «Остеомед». Результат — на сегодняшний день более чем у 10 тысяч его пациентов не наблюдались повторные переломы. Надо заметить, что такой заслуги нет ни у одного иностранного лекарственного препарата, предназначенного для лечения остеопороза.
“Актуальные проблемы остеопороза”.
Монография
под редакцией
профессора, доктора медицинских наук,
зав. кафедрой педиатрии ГОУ ДПО
Пензенского института усовершенствования врачей
В.И. Струкова.
Авторский состав:
В. И. Струков,
М. Ю. Сергеева-Кондраченко,
О. В. Струкова-Джоунс,
Р. Т. Галеева, Л. Г. Радченко,
М. Н. Гербель, Е. Б. Шурыгина,
Л. Д. Романовская, Н. В. Еремина,
Н. А. Вирясова.
Рецензенты:
Л. М. Житникова, д.м.н., профессор кафедры семейной медицины
ММА им. И.М. Сеченова,
исполнительный директор Общероссийской Ассоциации
врачей общей практики.
В. А.Кельцев, д.м.н., профессор,
заведующий кафедрой факультетской педиатрии
ГОУ ВПО Самарского медицинского университета.
Типография «Ростра», 2009. с.342
Вторичный остеопороз является следствием самых различных по этиологии заболеваний (см. табл. 3). В результате снижения костной массы переломы костей, как и при первичном остеопорозе, имеют типичные места: тело позвонков, дистальный отдел лучевой кости, проксимальный отдел плечевой кости, шейка бедра и область вертелов бедренной кости. В телах позвонков встречаются как истинные компрессионные переломы, так и «ползучая» деформация при образовании «рыбьих» позвонков вследствие микропереломов.
В последние годы выполнено большое количество метаанализов, систематических обзоров и крупных проспективных когортных исследований по оценке влияния различных заболеваний на риск развития остеопоротических переломов. Среди заболеваний, увеличивающих риск развития остеопороза, следующие:
- сахарный диабет 2 типа – повышает риск развития переломов бедра как у мужчин, так и у женщин (уровень доказательности А);
- ревматоидный артрит (уровень доказательности А);
- целиакия – повышает риск развития переломов (уровень доказательности А);
- хронические воспалительные заболевания кишечника: язвенный колит, болезнь Крона (уровень доказательности С);
- трансплантация неполых органов (печень, легкие, сердце, почки, костный мозг). Скорость потери костной ткани может достигать 10% в первый год после трансплантации, особенно при трансплантации печени и почек. При этом риск развития остеопороза и переломов постоянно повышается в первые 2-3 года (уровень доказательности С).
В существующих клинических рекомендациях все другие заболевания приводятся с уровнем доказательности С:
- заболевания эндокринной системы (болезнь и синдром Иценко-Кушинга, тиреотоксикоз, гиперпаратиреоз, гипогонадизм, инсулинозависимый сахарный диабет);
- ревматические заболевания (системная красная волчанка, анкилозирующий спондилоартрит);
- заболевания органов пищеварения (состояние после резекции желудка, мальабсорбция, хронические заболевания печени);
- заболевания почек (хроническая почечная недостаточность, почечный канальцевый ацидоз, синдром Фанкони);
- заболевания крови (миеломная болезнь, талассемия, системный мастоцитоз, лейкозы, лимфомы);
- генетические нарушения (несовершенный остеогенез, синдром Марфана, синдром Элерса-Данло (несовершенный десмогенез), гомоцистинурия и лизинурия);
- хронические обструктивные заболевания легких.
Все эти состояния часто проявляются остеопорозом, потому остеопороз можно рассматривать как мультифакторное заболевание.
Содержание
4.1. Стероидный остеопороз
М.Ю. Сергеева-Кондраченко, О.В. Струкова-Джоунс
Немного глюкокортикоидов, как стакан вина,
Могут быть полезными многим (пациентам).
Много глюкокортикоидов, как бутылка вина, – вредны всем.
Т. Пинкус
Стероидный (глюкокортикостероидный) остеопороз вызывается патологическим повышением эндогенной продукции глюкокортикоидов (ГК) надпочечниками или возникает при введении синтетических аналогов ГК, широко применяемых при многих заболеваниях и состояниях чаще всего в качестве иммунодепрессантов и противовоспалительных средств.
При экзогенном гиперкортицизме (в результате терапевтического применения ГК) остеопороз развивается у 30-50% больных, его частота и выраженность зависят от длительности ГК-терапии и суммарной дозы препарата, а также возраста и массы тела больного, но мало зависят от способа введения (перорально, внутримышечно, путем ингаляции или внутрисуставно).
При эндогенном гиперкортицизме (синдром или болезнь Иценко-Кушинга) остеопороз выявляют у 50-95% больных. При этих заболеваниях эндогенная продукция кортикостероидов увеличивается в 4-10 раз по сравнению с нормой. Хроническое действие высоких концентраций эндогенного кортизола ведет к остеопении, остеопорозу, переломам.
Кроме того, ГК применяются в клинике при лечении многих заболеваний. Полагают, что осложнения при стероидной терапии развиваются в 20-100% случаев и зависят от длительности, вида, гормонотерапии и индивидуальной чувствительности к ГК. Наиболее серьезным в плане инвалидизации и смертности считают стероидный ОП, возникающий, по разным данным, в 5-10 % случаев (Смаков Г. М.). Частота возникновения патологических переломов у больных, получающих системные ГК, 30-50% (Aurdan M. D., Скрипникова И. А.). До сих пор дискутируется минимальная доза ГК, вызывающая изменения в костной ткани (см. рис. 5). Некоторые авторы (Rondier J., Скрипникова И. А., Дженнари К.) полагают, что клинически выраженный ОП развивается при приеме надфизиологических доз ГК, превышающих 7,5 мг эквивалента преднизолона в сутки. Eastell D. утверждает, что риск переломов у лиц, получающих 7,5 мг преднизолона в сутки, вдвое выше по сравнению с контрольной группой лиц, не получавших ГК. Относительно дозы в 2,5-5 мг существуют статистически недостоверные и противоречивые данные (Скрипникова И. А.) Не существует единого мнения относительно длительности ГК терапии, приводящей к развитию клинически выраженного ОП. Eastell D. полагает, что изменения в костной ткани возникают уже спустя год после проведения интенсивной стероидной терапии. Согласно Емельянову А. В., ОП развивается спустя 2-4 года постоянного приема гормонов в средне терапевтической дозе 5-7,5 мг в сутки в пересчете на преднизолон.
Для стероидного остеопороза прежде всего характерно поражение костей осевого скелета – тел позвонков, ребер, костей таза и свода черепа, развитие асептического некроза головки бедренной кости. Последний чаще встречается при экзогенном гиперкортицизме.
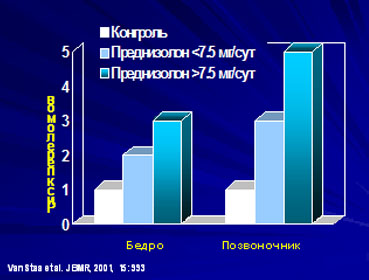
Рис. 5. Риск переломов при лечении глюкокортикоидами
Факторы риска стероидного остеопороза. Существуют определенные факторы риска, усугубляющие развитие стероидного ОП. Полагают, что изящные, небольшого роста женщины со светлой кожей (особенно из стран Азии и Северной Европы), бездетные или имеющие только одного или двух детей, с семейным анамнезом переломов позвоночника и шейки бедра и курящие, имеют более высокий риск развития остеопоротических переломов (Деквайкер Я.). ГК индуцированный ОП чаще развивается у женщин постменопаузального возраста со сниженным эстрогеновым фоном. Стероидному ОП чаще подвержены дети, поскольку в связи с ускоренными метаболическими процессами детский организм раньше реагирует на гормональное вмешательство, и лица старше 50 лет. Гипогонадизм, ранняя длительная менопауза утяжеляют течение стероидного ОП (Raid I.R.). Курение, способствуя развитию ранней менопаузы женщин, увеличивает риск развития ГК индуцированого ОП. Низкая физическая активность больных, получающих ГК, может быть следствием стероидной миопатии или тяжести общего состояния – в любом случае ограничение подвижности усугубляет патологический процесс в кости . Eastell D. полагает, что астеническое телосложение является фактором риска развития стероидного ОП.
Патогенез стероидного остеопороза является сложным и зависит от различных эффектов ГК на костный метаболизм и фосфорно-кальциевый обмен. ГК угнетают костеобразование, способствуют потере кальция с мочой и снижению абсорбции кальция в желудочно-кишечном тракте, уменьшают продукцию половых стероидов, тем самым снижая их анаболический эффект на кость. Большинство авторов склоняются к мнению, что ГК вызывают отрицательный баланс кальция в организме, влияя на кальцийрегулирующую систему, главными представителями которой являются «кальцитропные гормоны»: кальцитонин, 1,25 дигидроксивитамин D и паратгормон (Jones G.D.), в чем проявляется системное действие ГК. Локальные эффекты на кость обусловлены катаболическим действием стероидов, что выражается в преобладании процессов резорбции над костеобразованием (Скрипникова И. А.). Патогенез стероидного остеопороза представлена на рис. 6.
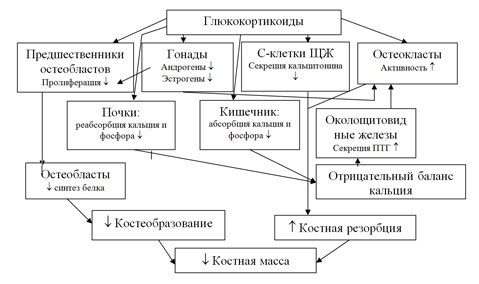
Рис. 6. Схема патогенеза стероидного остеопороза
ГК вызывают распад в кишечной клетке 1,25(ОН)2 витамина D3 до неактивных метаболитов, к которым энтероциты нечувствительны, или способствуют ускоренному катаболизму активных метаболитов витамина D3. Кроме энтероцитов, клетками-мишенями для активных метаболитов витамина D является эпителий почечных канальцев, в которых под его влиянием увеличивается реабсорбция ионов кальция и фосфора. Воздействие ГК на почечные канальцы сходно их влиянию на энтероциты, при этом происходит увеличение экскреции ионов кальция с мочой посредством ионной диффузии (Schatz D.).
Мальабсорбция солей кальция запускает “вторичный гиперпаратиреоидизм”, действие ПТГ направлено в этом случае на нормализацию ионного состава крови и предупреждение развития гипокальциемии (Auran M. D., Adami S. D., Hosking D. J.). ПТГ посредством специфических рецепторов на остеобластах вызывает их активацию. Запуск деятельности остеокластов происходит вторично под влиянием особого водорастворимого фактора, вырабатываемого остеобластами. Показано, что уже через 30 минут после введения ПТГ наблюдается увеличение активности и количества остеобластов в костной ткани, но при обязательном присутствии культуры остеобластов. Действие ПТГ на костную ткань проявляется мобилизацией ионизированного кальция и переходом его из кости во внеклеточную жидкость. При достаточно длительном воздействии повышенной концентрации ПТГ наряду с деминирализацией костной ткани наблюдается деструкция органического матрикса кости, в связи с чем возрастает экскреция оксипролина (маркер коллагенолиза) с мочей (Ковалев Д.И.).
Возможна прямая стимуляция синтеза ПТГ глюкокортикоидами, что показано в опытах с культурой ткани железы при добавлении кортизола (Бабарыкин Д. А.).
Кальцитонин является главным функциональным антагонистом ПТГ. Вопрос о влиянии ГК на секрецию кальцитонина парафолликулярными клетками щитовидной железы у больных изучен мало (Бабарыкин Д. А.)
К системным эффектам ГК относят также их угнетающее действие на выработку половых гормонов, синтез которых контролируется гипоталамо-гипофизарно-надпочечниковой системой. Повышение содержания ГК в крови приводит к снижению выработки кортиколиберинов и АКТГ, опосредующих синтез эстрогенов и андрогенов, оказывающих протективное действие на кость.
Таким образом, ГК вмешиваются в кальцийрегулирующую систему, приводя к сдвигам метаболических процессов в костной ткани в сторону резорбции.
Необходимо отметить и двухфазность местного влияния ГК на обменные процессы в костной ткани: в физиологических концентрациях стероиды обладают анаболическим эффектом, а при длительном воздействии надфизиологических доз вызывают катаболические процессы.
Не существует однозначного мнения о способности разных препаратов ГК индуцированного ОП. Rondier J. полагает, что все системные ГК в эквивалентных дозах способны вызывать ОП в одинаковой степени, отличается лишь индивидуальная чувствительность клеток костной ткани к гормонам, Chen T. J. распределяет ГК по их способности вызывать ОП следующим образом триамсинолон > дексаметазон > кортизол > кортикостерон. Дифлазокорт является недавно синтезированным ГК с минимальным влиянием на формирование патологии кости (Joseph J. C., Markham D.).
По поводу действия ИГК на костный метаболизм на страницах современной научной литературы развернута живая дискуссия (см. рис. 7). Трудность оценки влияния ИГК на кость заключается в том, что большинство пациентов, получающих эти препараты, уже так или иначе принимали короткие или длинные курсы гормонотерапии, которые должны были отразиться на костной ткани. Кроме того, многие хронические заболевания, при которых используются ГК, сами по себе изменяют образ жизни пациента в сторону гиподинамии, что может вызвать остеопению.
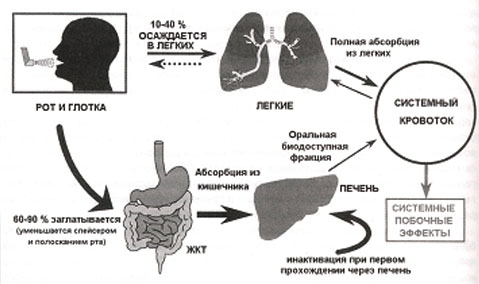
Рис. 7. Механизм системной биодоступности ИГКС по D. Allen
Клиника. У взрослых больных со стероидным остеопорозом наблюдается уменьшение роста на 2-10 см, а при большей длительности заболевания – на 10-15 см; одновременно увеличивается грудной кифоз и происходит наклон таза спереди. Если болезнь начинается в детском возрасте, то отмечается значительное замедление темпов роста. Развитие стероидного остеопороза характеризуется медленным нарастанием потери костной массы и деформацией позвонков и длительное время может протекать бессимптомно. Для стероидного остеопороза характерны переломы ребер, проявляющиеся болями в грудной клетке. Болевой синдром объясняют костными микропереломами и раздражением периоста. При развитии асептического некроза головок бедренных костей у больных нарушается походка – она становится «утиной».
Диагностика. Стандартная рентгенография является наиболее доступным рентгенологическим методом диагностики стероидного ОП. Наиболее информативными для диагностических исследований считают снимки области таза, позвоночника, лучезапястного и голеностопных суставов, кисти, черепа, при этом учитывают изменение соотношения между диаметром кости и толщиной расширения костномозгового канала, повышение прозрачности костей, истончение костных трабекул и замыкательных пластинок суставных впадин. В телах позвонков выявляют повышенную контрастность замыкательных пластинок и вертикальную исчерченность за счет утолщения остаточных, наиболее загруженных трабекул. В тяжелых случаях остеопороз выдают его осложнения: изменение высоты и формы тел позвоночника за счет компрессии и даже переломов. Считают (Родионова С. С.), что для стероидного ОП характерна деформация позвонков по типу «рыбьих», а клиновидное изменение встречается реже. При стероидном ОП на рентгенограммах также встречаются зернистые очаги просветления в костях черепа и кистей рук. Обзорная рентгенограмма позволяет выявить стероидный ОП при потере костного вещества на 30-40% (Лепарский Е. А., 1996 г.), что, конечно же, указывает на невозможность ранней диагностики при помощи этого метода.
Абсорбционная рентгеновская денситометрия является одним из наиболее объективных количественных методов исследования, и ее показатели считают наиболее достоверными в плане диагностики стероидного ОП (Харченко В. П., Смирнов А.). Основными показателями, определяющими минерализацию костной ткани, являются минеральное содержание кости (масса костной ткани – ВМС), выраженное в граммах минерала на 1 сантиметр кости, и минеральная плотность кости (ВМD), рассчитываемая на диаметр кости и выражаемая в граммах на квадратный сантиметр.
Снижение ВМD меньше 2-2.5 единиц стандартного отклонения без коррекции неизбежно переходит в ОП.
Изучение биохимических маркеров костного метаболизма при эндогенном гиперкортицизме свидетельствует об одновременном наличии признаков сниженного костеобразования и усиленной костной резорбции, что, видимо, и приводит к быстрому развитию остеопороза.
Терапия и профилактика стероидного остеопороза. Увеличение кальция в рационе широко применяются в профилактике и лечении стероидного ОП. Полагают, что суточная потребность пациентов в кальции составляет 1000-1500 мг (Насонова, Worth H.). Однако недавно было показано, что изолированное назначение кальция не приводит к прекращению потери костной массы вследствие действия стероидов (Дженнари К.).
В настоящее время для лечения метаболических остеопатий и гипокальциемических состояний применяют три группы препаратов витамина D (Рожинская Л. Я.): эргокальциферол (витамин D2), дигидротахистерол и активные метаболиты витамина D (кальцитриол, альфакальцидол). “Дигидротахистерол” (“Тахистин”) является структурным аналогом витамина D, применяется при гипопаратиреозе, способствует усилению всасывания кальция в кишечнике и при этом почти не влияет на костный метаболизм. Препарат дозируется в мг, выпускается в виде 0.1% раствора. Альфакальцидол (1 -α альфа-гидроксихолекальциферол), выпускаемый под названиями “Оксидевит” (Россия), “Альфа-Д3-Тэва” (Израиль), “Ван-Альфа” (Япония), всасывается в неактивном виде и при трансформации через печень превращается в кальцитриол, оказывающий выраженный остеопротективный эффект. Синтетические препараты кальцитриола более эффективны при гипокальциемических состояниях, а в действии альфакальцидола преобладает его метаболическое свойство. Недавно обнаружено, что остеобласты способны превращать альфакальцидол в кальцитриол непосредственно в костной ткани, что является преимуществом этого препарата перед другими формами витамина D (Рожинская Л. Я).
При стероидном ОП альфакальцидиол применяют в дозировке 0.5-1.0 мкг (10.000 – 20.000 МЕ) в день длительно в течение нескольких лет (Рожинская Л. Я.). Наилучшей считается комбинация альфакальцидиола с препаратами кальция (1000 мг\сутки) и интраназальным введением кальцитонина (400 МЕ/сутки) (Dechant K. L.).
Эффективность анаболических стероидов и флюориды в комбинации с препаратами кальция подвергается сомнению.
Таким образом, отсутствие или противоречивость стратегии ведения пациентов, получающих стероидную терапию, делают актуальными любые исследования в этой области. Более подробно о лечение стероидного остеопороза представлено в следующем разделе монографии.
4.2. Профилактика и лечение стероидного остеопороза
О. В. Струкова-Джоунс, М. Ю. Сергеева-Кондраченко
Глюкокортикоидная терапия связана с потерей костного вещества, что особенно интенсивно происходит в первые месяцы терапии. Риск переломов при применении стероидов больше, чем при постменопаузальном остеопорозе. Поэтому стероидный остеопороз должен агрессивно лечиться на ранних стадиях, чтобы предотвратить переломы, особенно у той категории лиц, которые склонны к переломам (лица с остеопениями и пожилые).
Профилактика стероидного остеопороза:
- Включение в диету продуктов, богатых кальцием.
- Оптимальный режим физических нагрузок.
- Назначение профилактических доз солей кальция (500 – 1000 мг/сут.).
- Назначение профилактических доз витамина D (400 -1000 МЕ/сут.).
Лечение стероидного остеопороза:
- Включение в диету продуктов, богатых кальцием.
- Оптимальный режим физических нагрузок.
- Назначение лечебных доз солей кальция.
- Назначение лечебных доз витамина D (1000–10000 МЕ).
- Назначение кальцитонина (миокальцика) 100 ЕД 2 раза в день 2 недели, затем 50 МЕ 2 раза в день 2 недели, затем 50 МЕ 3 раза в неделю 1-2 мес., перерыв 2 месяца. Таких курсов за год 3 в течение 3 лет.
В целом меры для профилактики и лечения стероидного остеопороза не отличаются от ведения пациентов с другими формами остеопороза, не связанными с применением глюкокортикоидов. Однако есть свои особенности, включающие общие и специальные подходы.
Общие меры должны быть направлены на профилактику потери костного вещества:
- Доза и продолжительность лечения глюкокортикоидами должны быть настолько минимальными, насколько позволяет состояние больного, поскольку даже гормонозаместительная терапия при надпочечниковой недостаточности может привести к потере костного вещества.
- По возможности альтернативная глюкокортикоидам терапия должна применяться, если это позволяет диагноз.
- В случае применения глюкокортикоидов, местной терапии должно отдаваться предпочтение, например, применение ингаляционных препаратов при бронхиальной астме или стероидных клизм, при болезни Крона или язвенном колите.
- В качестве приемлемой альтернативы применяются пульсовые дозы на протяжении короткого промежутка времени вместо длительной терапии на протяжении недель и месяцев.
- Пациенты должны заниматься физическими упражнениями с ношением легких или умеренных тяжестей, например, гантелей, по меньшей мере 30 минут в день для защиты костного вещества и профилактики глюкокортикоид индуцированной атрофии мышц.
- Пациенты должны избегать курения, избытка алкоголя и применять меры для профилактики падений.
Специфические меры
Кальций и витамин D. Кортикостероиды в дозах, превышающих физиологические (доза преднизона более 7 мг/день), непосредственно угнетают образование костной ткани, препятствуют всасыванию кальция в кишечнике и усиливают экскрецию кальция почками. Вследствие этих множественных эффектов в течение 6 месяцев от начала лечения кортикостероидами может развиваться остеопороз. Глюкокортикоиды вызывают негативный баланс кальция путем снижения его адсорбции в кишечнике и увеличении его экскреции с мочой. Согласно рекомендациям Американской Ассоциации Ревматологов пациенты, применяющие стероиды, должны получать 1000-1500 мг кальция и 800 ед. витамина D ежедневно. Если экскреция кальция с мочой превышает 300 мг, можно добавить тиазидный диуретик. Сообщается, что как кальцитонин, так и бисфосфонаты предотвращают или уменьшают потерю костной ткани у этих пациентов. В качестве альтернативы в настоящее время проводится исследование кортикостероидов, щадящее воздействующих на костную ткань.
Хотя применение кальция и витамина D необходимо для пациентов, находящихся на глюкокортикоидной терапии, этих мер недостаточно для предотвращения потери костного вещества у пациентов, получающих высокие дозы стероидов [8, 11].
Активные метаболиты витамина D. Активные метаболиты витамина D такие, как кальцитриол или альфакальцидиол, были изучены для профилактики и лечения стероидного остеопороза. Кальцитриол, наиболее активный метаболит витамина D, в сочетании с препаратами кальция предотвращает потерю костного вещества в позвоночнике больше, чем прием препаратов кальция без добавок витамина D [9, 12]. Метаанализ 5 клинических исследований активных метаболитов витамина D у пациентов на глюкокортикоидной терапии показал увеличение BMD в позвоночнике, однако данных по предотвращению стероидноиндуцированных переломов недостаточно [13].
Однако активный препарат витамина D приводит к гиперкальцемии, гиперкальциурии, что является негативным фактором для больных, у которых стероиды уже приводят к увеличенной экскреции кальция с мочой. Бисфосфонаты не оказывают подобного влияния на метаболизм кальция (9-14, 16).
Бисфосфонаты. Этидроновая кислота является активным бифосфонатом, угнетающим остеокластическую функцию. Ученые констатируют хорошую эффективность этидронатов и приводят данные об их эффективности в дозировках 5-10 mg/кг веса в течение 6 месяцев, предполагая, что данные препараты в виде прерывистых курсов эффективны для предотвращения стероидного ОП. Существует большая база данных относительно применения антирезорбтивных препаратов, к которым относятся бисфосфонаты. Полагают, что механизм действия бисфосфонатов в этом случае связан со способностью этих препаратов усиливать апоптоз (программированной гибели) остеокластов [17] . Однако клюкокортикоиды могут нивелировать проапоптотический эффект бисфосфанатов. Существует мнение, что эти препараты предотвращают гклюкокортикоидный остеопороз, продлевая продолжительность жизни остеобластов [18].
“Алендронат” и “Ризедронат” являются наиболее применимыми препаратами для профилактики и лечения стероидного остеопороза в США [10, 11, 19-21]. Исследования показали, что “Алендронат” приводит к увеличению BMD в позвоночнике, шейке бедра, а также во всем костном скелете. Причем этот эффект наступал от 1-2 доз препарата и сохранялся в течение 2 лет после применения “Алендроната”. Также было показано, что у пациентов, применявших этот препарат, риск переломов позвоночника был меньше. Что касается “Ризендроната”, этот препарат также приводит к увеличению минеральной плотности кости и снижению рисков переломов. Другие бисфосфонаты, такие как “Памидронат”, “Этидронат” и “Клодронат” также применяются [8, 22-24, 25-29], однако они не утверждены к применению в США. Клодронат – бисфосфонат, который применяется при стероидном остеопорозе, при бронхиальной астме [30].
Показания для терапии бисфосфонатами. Терапия назначается лицам с высоким риском переломов:
- Пациенты с предыдущими переломами.
- Пожилые пациенты.
- Пациенты, применяющие глюкокортикоиды в дозировке более 5 мг в день ежедневно на протяжении 3 и более месяцев.
Лица, у кого риск переломов отсутствует, предлагается проведение денситометрии перед началом глюкокортикоидной терапии, а также в течение терапии. Бисфосфонаты, “Алендронат” или “Резидронат”, применяются у постменопаузальных женщин и мужчин с Т-шкалой -1.5 и менее. У беременных женщин применение бисфосфонатов не желательно, поскольку влияние этих препаратов на развитие плода не изучено.
Паратиреоидный гормон. Паратиреоидный гормон стимулирует новообразование костного вещества, а также способствует его резорбции. Кратковременное назначение паратгормона в большей степени способствует новообразованию кости, чем ее резорбции. Паратирероидный гормон является перспективной терапией остеопороза в целом (35), однако исследований по применению паратгормона при глюкокортикоидном остеопорозе недостаточно, чтобы сделать вывод о его эффективности.
Гормонозаместительная терапия. Глюкокортикоиды приводят к снижению продукции половых гормонов [37]. Таким образом, логична гормонозаместительная терапия эстрогенами и андрогенами. Однако применение комбинированной эстрогенопрогестиновой терапии у постменопаузальных женщин связано с увеличением риска рака груди, инсультов и тромбоэмболизма [39] . Таким образом, гормонозаместительная терапия эстрогенами не относится к первоочередным препаратам для профилактики постменопаузального остеопороза. Кроме того, нет оснований полагать, что эстрогены показаны для пременопаузальных женщин с сохраненным менструальным циклом. Женщинам с нерегулярным менструальным циклом во время терапии глюкокортикоидами рекомендуется применение комбинированных оральных контрацептивов, если они не противопоказаны [6]. Аналогично мужчинам с глюкортикоидным индуцицированным гипогонанизмом рекомендовано применение тестостерона, например, было показано, что ежемесячное внутримышечное введение 250 мг тестостерона приводило к увеличению минеральной плотности кости в позвоночнике [40]. Кроме того, препарат тестостерона у пациентов, применяющих высокие дозы кортикостероидов, способствует укреплению мышечной массы, нормализации либидо [41].
Кальцитонин. Показано, что кальцитонин, применяемый интраназально или подкожно у больных со стероиднозависимой бронхиальной астмой, приводит к сдерживанию потери костного вещества [42, 43]. Однако не было доказано, что кальцитонин уменьшает риск переломов у пациентов, находящихся на стероидной терапии [44]. Следовательно, он не является препаратом выбора для профилактики и лечения глюкокортикоидного остеопороза [36]. Хотя кальцитонин угнетает процесс резорбции, было показано его угнетающее влияние на жизнеспособность остеокластов и активацию новых костных единиц (Rasmussen, 1981 г.), что ограничивает его изолированное применение при стероидном ОП. Комбинированная терапия кальцитриолом, препаратами кальция и кальцитонина, возможно, позволяет предотвратить потерю костной массы у лиц, получающих ГК, однако, отсутствие длительных проспективных исследований в этом направлении ограничивает возможность сравнительной оценки эффективности препаратов витамина D и кальцитонина. Значительная дозировка (400 МЕ в сутки), возможность привыкания со снижением активности, необходимость длительного приема (до 6-ти месяцев) и повторных курсов при высокой стоимости препарата подвергают сомнению доступность такой терапии у наших пациентов. Учитывая гипокальциемический эффект, кальцитонин в США в настоящее время занял основную нишу – лечение гиперкальциемических состояний, возникающих при остеопоротических переломах.
Тиазидные диуретики и ограничение соли в диете. Тиазидные диуретики так же, как диета с пониженным содержанием соли, способствуют снижению экскреции кальция с мочой и, возможно, уменьшают негативный баланс кальция при применении стероидов [45]. Однако их эффект в уменьшении риска переломов или влияние на минеральную плотность кости не ясен. В общей популяции применение тиазидных диуретиков ассоциируется с увеличением минеральной плотности кости. Терапия тиазидными диуретиками более 2 лет связана с уменьшением переломов шейки бедра [46-49]. Хотя данные об стабилизации или увеличении минеральной плотности кости у пациентов, применяющих стероиды на фоне тиазидных диуретиков, отсутствуют, тиазиды могут быть рекомендованы для лечения гипертонии у пациентов, находящихся на глюкокортикоидной терапии.
Эффект от прекращения глюкокортикоидной терапии. Большинство авторов считают, что глюкортикоидный остеопороз – это обратимое состояние. После прекращения экзогенной глюкокортикоидной терапии или нормализации гормонального статуса после лечения болезни Кушинга происходит увеличение минеральной плотности кости [50, 51]. Обычно нормализация костного вещества наступает спустя 6 месяцев после прекращения терапии.
Рекомендации Американской Ассоциации Ревматологов. Рекомендации разработаны для предотвращения потери костного вещества и переломов у пациентов, кому назначается терапия глюкокортикоидами в дозировке 5 и более мг в пересчете на преднизолон ежедневно на протяжении 3 и более месяцев, или у пациентов, у которых Т-шкала менее -1,5.
- Кальций – 1000-1500 мг в день. Витамин D – 800 ед. в день.
- Терапия бисфосфонатами. Для удобства пациентов назначается 1 раз в день – “Алендронат” 35 мг в неделю для профилактики и 70 мг в неделю для лечения. “Ризендронат” 35 мг в неделю для лечения и профилактики.
- При непереносимости бисфосфонатов или, если бисфосфонаты противопоказаны, рекомендуется кальцитонин. Если у пациента имеется болевой синдром, вызванный остеопоратическим переломом, рекомендуется интраназальный кальцитонин в дозировке 200 ед. в день.
- Гормонозаместительная терапия тестостероном для мужчин.
Пациент должен наблюдаться ежегодно с проведением денситометрии. По возможности необходимо рекомендовать упражнения, направленные на предотвращение потери костного вещества.
Европейские рекомендации по ведению ГК остеопороза. Рекомендации Бельгийского Сообщества по здоровью кости. Всем пациентам, применяющим глюкокортикоиды в дозировке 7,5 и более мг в пересчете на преднизолон ежедневно на протяжении 3 и более месяцев, рекомендованы препараты кальция (500-1000 мг в день) и витамина D (800-1000 МE в день), а также бисфосфонаты (“Алендронат” или “Ризендронат”). Лечение проводится до окончания терапии стероидами [52].
Ряд исследователей отмечает возможность обратимости стероидного остеопороза при отмене ГК или излечении эндогенного гиперкортицизма.
Тактика ведения пациентов, получающих глюкокортикоидную терапию с целью профилактики остеопороза
- контроль Са и фосфора в сыворотке крови 1 раз в 3- мес;
- контроль суточной экскреции Са, ЭКГ 1 раз в 3-6 мес;
- остеоденситометрия – не реже 1 раза в год.
ЭКГ- критерии гипокальциемии:
- удлинение интервала QT;
- расширение QRS комплекса;
- удлинение сегмента ST.
Таблица 7
Тактика ведения пациентов, получающих терапию препаратами кальция с учетом его суточной экскреции
| Данные суточной экскреции с мочой | Интерпретация данных | Тактика ведения |
| 1.5-3.5 мг/кг | нормальный уровень | продолжение терапии |
| < 1 мг/кг | ? мальабсорбция | консультации специалистов (нефролога, эндокринолога) |
| > 3.5 мг/кг | подозрительно на быстрый остеолизис или гиперабсорбцию Са |
Тест рекомендуется проводить через три месяца после начала терапии кальцием.
Тактика ведения пациентов, получающих терапию препаратами витамина D и его активными метаболитами:
– контроль Са, Р, креатинина в крови – 1 раз в 3 мес.;
– контроль трансаминаз и щелочной фосфатазы – 1 раз в 4-6 мес.
В следующем разделе монографии представлены литературные сведения и результаты собственных исследований о роли различных эндокринных заболеваний в развитии вторичного остеопороза.
4.3. Остеопатии эндокринного генеза
М.Ю. Сергеева-Кондраченко
Остеопороз при нарушениях функции щитовидной железы
Гормоны щитовидной железы участвуют в физиологической регуляции процессов роста, включая рост костей в пубертатном периоде и процесс костного ремоделирования в последующей жизни. Накоплено значительное число данных, демонстрирующих прямое действие тиреоидных гормонов – тироксина и трийодтиронина – на костную ткань. Во всех участках костной и хрящевой ткани обнаружена экспрессия их рецепторов как в остеобластах, так и в остеокластах.
Остеопороз при гипертиреозе. Гипертиреоз ведет к повышению костного обмена за счет увеличения количества остеокластов и резорбционных поверхностей, а также нарушения соотношения резорбционных и костеобразующих пространств. Увеличение резорбции костной ткани, вероятно, является причиной гиперкальциемии, которая встречается почти у 50% больных тиреотоксикозом, в то время как уровни ПТГ и 1,25(ОН)2D3 снижены и уменьшена кишечная абсорбция кальция. Гипертиреоз обуславливает усиление остеобластической функции, что выражается в увеличении в крови содержания остеокальцина и повышении активности ЩФ. Однако усиление костеобразования при этом не компенсирует резкого повышения костной резорбции. В результате уменьшается костная масса и МПКТ в проксимальных отделах бедренной кости и позвоночнике (особенно у женщин).
Остеопенический синдром развивается у больных с диффузным и смешанным токсическим зобом и токсической аденомой вследствие значительного повышения секреции тиреоидных гормонов. Не меньшее влияние могут оказать и синтетические аналоги тиреоидных гормонов, применяемые при клинической картине гипотиреоза, к частым причинам которого относятся аутоиммунный тиреоидит и тиреоидэктомия.
При избытке тиреоидных гормонов наиболее подвержены остеопорозу женщины в период менопаузы, больные с длительно нелечившимся эндогенным тиреотоксикозом и лица, получающие тиреоидные гормоны в супрессивных дозах (более 150 мкг тироксина в день после операции по поводу рака щитовидной железы).
Диагностика. У пациентов с декомпенсированным тиреотоксикозом, особенно у пожилых женщин, обнаруживается гиперкальциемия, возникающая, по-видимому, в результате повышения резорбции костной ткани, хотя одновременно под действием тиреоидных гормонов происходит увеличение почечного клиренса кальция, и нарушается его всасывание в кишечнике. При тиреотоксикозе также наблюдается нарушение метаболизма фосфора, что проявляется увеличением как уровня фосфора в крови, так и его экскреции с мочой.
Длительный избыток в организме тиреоидных гормонов влияет на уровень кальцийрегулирующих гормонов: показано снижение секреции ПТГ и кальцитонина, имеются указания на недостаточность кальцитриола, связанную со снижением его образования в почках. При анализе показателей костного обмена у больных с гипертиреозом выявлено повышение активности щелочной фосфатазы и остеокальцина.
По данным измерения МПКТ (методом DEXA), остеопения у больных тиреотоксикозом выявляется в проксимальных отделах бедренной кости, но не в позвоночнике. Степень ее выраженности достоверно отрицательно коррелировала с длительностью заболевания. Показатели МПКТ у больных тиреотоксикозом представлены на рис. 8.
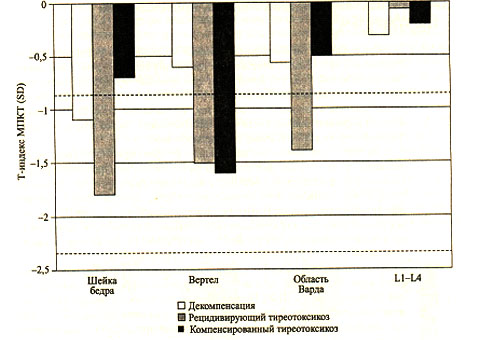
Рис. 8. Показатели МПКТ у больных тиреотоксикозом
Пациенты с избыточной продукцией тиреоидных гормонов относятся к группе риска по возникновению переломов, особенно шейки бедра. Наиболее подвержены переломам женщины в постменопаузе с рецидивирующим течением тиреотоксикоза. Исследования показали, что наличие тиреотоксикоза в анамнезе повышает риск возникновения переломов в постменопаузе у женщин в 2,4 раза по сравнению с теми, кто не перенес этого заболевания.
Лечение. Прогноз в отношении остеопенического синдрома зависит от успеха терапии основного заболевания, которая должна быть направлена на полное его излечение. Длительная неполная ремиссия тиреотоксикоза, рецидивирующее течение приводят к дальнейшему снижению костной массы и прочности кости и, как правило, к переломам.
Сниженная МПКТ у больных тиреотоксикозом может восстанавливаться после достижения стойкого эутиреоидного статуса, но остается открытым вопрос о сроках восстановления. Во многих работах показано, что у молодых женщин и мужчин, а также у женщин в пре- и постменопаузе с ремиссией тиреотоксикоза сохраняются явления остеопении в течение 3-5 лет, в связи с чем рекомендуется назначение пациентам препаратов остеотропного ряда: препаратов кальция, активных метаболитов витамина D, кальцитонина и бисфосфонатов.
Остеопороз при гипотиреозе. Снижение функции щитовидной железы влияет на костный метаболизм. Частота гипотиреоза увеличивается с возрастом. По некоторым данным, заболеванию подвержено 2,7% мужчин и 7,1% женщин старше 60 лет.
У больных с гипотиреозом без лечения выявляются нарушения кальциевого метаболизма: отмечается тенденция к снижению уровня кальция в крови и экскреции его с мочой. Повышен уровень ПТГ и 1,25(ОН)2D3. У пациентов с гипотиреозом замедлено костное ремоделирование – в 2-3 раза снижена скорость обеих составляющих ремоделирующего цикла – костной резорбции и костного формирования. Изменения опорно-двигательной системы у больных гипотиреозом представлены на рис. 9.
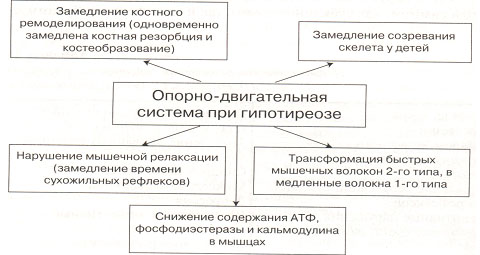
Рис. 9. Изменения опорно-двигательной системы при гипотиреозе
При оценке МПКТ наиболее существенные изменения обнаруживаются у больных с врожденным гипотиреозом и в случаях послеоперационного гипотиреоза. Показатели МПКТ у больных гипотиреозом представлены на рис. 10.
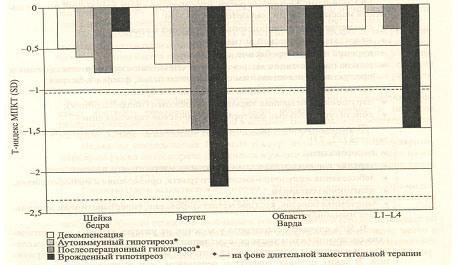
Рис. 10. Показатели МПКТ у больных тиреотоксикозом
На развитие остеопении при гипотиреозе в пременопаузальном возрасте у женщин оказывает влияние длительность тиреоидной терапии и ранний возраст ее начала, а также перенесенный тиреотоксикоз в анамнезе.
Таким образом, при заболеваниях щитовидной железы, характеризующихся избытком или недостатком продукции тиреоидных гормонов, происходит нарушение процессов ремоделирования костной ткани, в первом случае с усилением костного обмена, во втором – с его снижением, но в обоих случаях возможно развитие остеопенического синдрома.
Среди пациентов с заболеваниями щитовидной железы следует выделять группы повышенного риска тиреоидного остеопороза. К ним относятся больные с тиреотоксикозом в стадии декомпенсации и с рецидивирующим течением болезни, а также пациенты с первичным послеоперационным или врожденным гипотиреозом, длительное время находящиеся на заместительной терапии тиреоидными гормонами.
Гиперпаратиреоидная остеодистрофия
Первичный гиперпаратиреоз (ПГПТ) – эндогенное заболевание, связанное с развитием автономно функционирующих аденом и, реже, карцином паращитовидных желез. Иногда гиперпластический процесс формируется в нескольких железах. По данным американских исследователей, первичный гиперпаратиреоз является третьим по частоте эндокринным заболеванием. Обнаружен рост частоты гиперпаратиреоза с 25 случаев на 100 тыс. населения до 100 случаев.
В патогенезе заболевания главную роль играет избыточная секреция ПТГ аденомой или гиперплазированной тканью околощитовидных желез, что приводит к нарушению гомеостаза кальция, поражению костной системы, нарушению функциональной активности почек, желудочно-кишечного тракта, сердечно-сосудистой системы. Гиперсекреция ПТГ ведет к резкой активизации костного метаболизма с преобладанием костной резорбции, создается отрицательный костный баланс, рассасывание кости опережает образование новой кости. Возникает генерализованный остеопороз, происходит вымывание кальция из депо и возникает гиперкальциемия. Зависимость концентрации ПТГ от концентрации кальция представлена на рис. 11. Влияние ПТГ на почки проявляется его фосфатурическим эффектом, обусловленным снижением реабсорбции фосфата в проксимальных канальцах, что приводит к гиперфосфатемии, а также гиперкальциурическим действием на уровне дистальных канальцев.
Одним из основных проявлений заболевания служит прогрессирующая остеопения и патологические переломы костей. Поражение костной системы проявляется болями в стопах, трубчатых костях, усиливающимися при движении, болезненностью при пальпации костей. Позже возникают деформации скелета, так называемая «утиная» походка, переломы костей конечностей при малейшей травме, а иногда спонтанные.
Денситометрическое исследование позволяет объективно оценить потерю костной ткани. Наибольшие изменения обнаруживаются в костях кортикального строения: в проксимальной трети дистального отдела лучевой кости, проксимальных отделах бедра (большой вертел, диафиз бедра). В то же время в тяжелых случаях гиперпаратиреоидной остеодистрофии выявляется значительное снижение костной массы и в трабекулярных костях.
Своевременно поставленный диагноз и адекватно проведенное хирургическое лечение способствуют выздоровлению больного, но выраженная остеопения требует его дальнейшей реабилитации и контроля за состоянием костной системы и почечной функции.
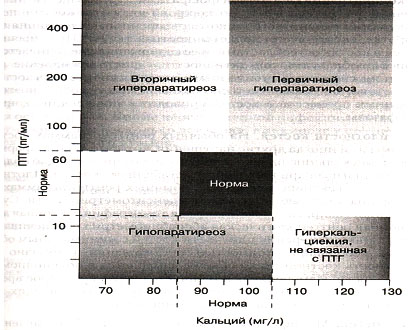
Рис. 11. Зависимость концентрации ПТГ от концентрации кальция
После удаления парааденомы и приема в течение года препаратов кальция и витамина D у трети больных МПКТ восстанавливается, достигая нормальных значений в поясничном отделе позвоночника, шейке и диафизе бедра. У части больных, имевших остеопороз, МПКТ повышается до уровня остеопении. Повышение МПКТ на 19-20% после удаления парааденомы происходит как в трабекулярных, так и в кортикальных костях, что указывает на обратимость нарушений костной структуры при этом заболевании.
Успех реабилитации больных зависит от возраста пациентов, выраженности нарушений в костной ткани, длительности заболевания.
Гипогонадальный остеопороз
Остеопороз у мужчин с гипогонадизмом
Гипогонадизм – одна из главных причин потери костной массы у мужчин. У каждого мужчины, имеющего остеопению или остеопороз, необходимо исследовать в крови уровень тестостерона, ЛГ и тестостерон-эстрадиол-связывающего глобулина для исключения гипогонадизма. Гипогонадизм выявляется примерно у 20-30% мужчин с переломами позвоночника и у 50% пожилых мужчин с переломами шейки бедра (несмотря на то, что недостаточность тестостерона не всегда бывает выражена клинически).
Андрогены играют важную роль в костном обмене как у женщин, так и у мужчин. Механизм действия андрогенов на костную ткань не вполне ясен. Имеются сообщения, что они стимулируют пролиферацию костных клеток. Было продемонстрировано наличие андрогенных рецепторов в остеобластоподобных клетках человека. По некоторым данным, андрогены увеличивают пролиферацию остеобластов и выработку ими ЩФ в дозозависимом режиме, а также усиливают синтез коллагена III типа. Предполагают, что, превращаясь в жировой ткани в эстрон, андрогены усиливают продукцию гормона роста и ИФР-I, тем самым оказывая дополнительное влияние на образование кости.
Клиника. Обычно пожилые мужчины с этой патологией (средний возраст 60 лет) предъявляют жалобы на сексуальную дисфункцию, имеющую место в последние 20-30 лет. Фактически причинами гипогонадизма (как первичного, так и вторичного), ассоциированного с остеопорозом, могут быть:
- синдром Клайнфельтера;
- гипогонадотропный гипогонадизм;
- гиперпролактинемия;
- орхит после перенесенного эпидемического паротита;
- первичная тестикулярная недостаточность в результате травматического поражения яичек;
- терапия гонадолиберином, применяемая для лечения опухоли предстательной железы.
Основной жалобой у 85% пациентов является боль в спине. Из них у 65% боль носит хронический характер, остальные жалуются на эпизодическую боль подострого характера и у 50% больных с хронической болью в области спины выявляются переломы позвонков. Однако и у пациентов с эпизодическими болями была обнаружена сходная частота переломов позвонков.
Диагностика. Выявление гипогонадизма у мужчин с остеопорозом может представлять определенные трудности. Это связано с тем, что при постпубертатном вторичном гипогонадизме нередко встречаются очевидно ложные результаты гормональных тестов, отсутствуют симптомы гипогонадизма (мужчины с недостаточностью тестостерона могут быть способны к адекватной сексуальной функции), сохраняется нормальный уровень общего тестостерона в крови.
У мужчин с компрессионными переломами позвоночника, учитывая преобладание вторичного остеопороза, рекомендуется проводить следующие исследования:
- клинический анализ крови;
- определение в крови содержания кальция, альбуминов, фосфора, а также ЩФ и 25-гидроксивитамина D3 для исключения нарушений минерального обмена, связанного, в частности, с гиперпаратиреозом и недостаточностью витамина D3;
- определение суточной экскреции кальция с мочой (для исключения гипер- или гипокальциурии);
- определение ТТГ и свободного Т4 для оценки функции щитовидной железы;
- определение в крови тестостерона, ЛГ, ТЭСГ и специфических простатических антигенов;
- иммуноэлектрофорез сыворотки крови и мочи у мужчин старше 50 лет с анемией;
- рентгенография позвоночника (при подозрении на перелом позвоночника); костная денситометрия (позвоночник и бедро), биопсия кости.
Лечение. Патогенетическим методом лечения остеопороза при гипогонадизме, за исключением гиперпролактинемического, является применение андрогенов. Восстановление функции половых желез после успешного лечения гиперпролактинемии приводит к достоверному увеличению плотности костей с преимущественно кортикальным строением. Кроме того, необходимо поддержание сбалансированной диеты с адекватным введением кальция (1000 мг в день у молодых мужчин и 1200-1500 мг в день у мужчин старше 65 лет) и витамина D (400-800 МЕ в день). Бисфосфонаты, кальцитонин лосося и стронция ранелат активно изучаются как препараты для лечения остеопороза у мужчин.
Остеопороз у женщин с гипогонадизмом
В основе гипогонадизма у женщин репродуктивного возраста лежит недостаточность функции яичников. Гипогонадизм может быть гипергонадотропным (первичным) и гипогонадотропным (вторичным).
Гипергонадотропный гипогонадизм характеризуется нарушением функции самих яичников вследствие различных врожденных или приобретенных нарушений. Приобретенный гипергонадотропный гипогонадизм возникает, например, в результате удаления яичников оперативным путем (хирургическая менопауза) или же угасания функции яичников вследствие облучения или химиотерапии.
Гипогонадотропный гипогонадизм у женщин – полиэтиологическое заболевание, развивающееся на фоне различных нарушений синтеза и секреции гонадотропинов. Снижение уровня гонадотропинов может быть изолированным, сочетаться с другими видами гипофизарной недостаточности или являться сопутствующей патологией при различных заболеваниях. Снижение уровня гонадотропинов и отсутствие цикличности их секреции приводит к угасанию функции яичников с развитием стойкой гипоэстрогении.
Патогенез. Гипоэстрогения приводит к ускоренной потере костной массы независимо от причин недостаточности функции яичников, поэтому механизмы формирования остеопороза при гипер- и гипогонадотропном гипогонадизме сходны с таковыми при постменопаузальном остеопорозе. Дефицит женских половых гормонов приводит к повышению активности всех фаз костного ремоделирования с нарушением баланса между костной резорбцией и костеобразованием в сторону преобладания резорбции (рис. 12).
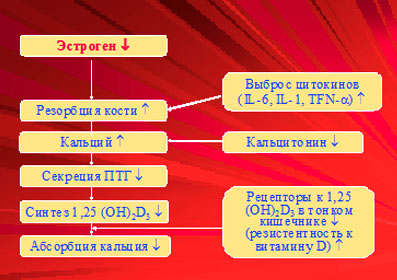
Рис. 12. Дефицит эстрогенов и остеопороз
Помимо увеличения поверхности резорбции, при недостатке эстрогенов наблюдается также углубление резорбционных полостей, что в конечном итоге приводит к нарушению трабекулярной архитектоники. Истончение и нарушение целостности отдельных трабекулярных элементов, а также разрушение соединительных связей между ними составляют отличительную черту остеопороза. Половые стероиды могут оказывать не только непосредственное, но и опосредованное влияние на костную ткань. У лиц с гипогонадизмом отмечается уменьшение продукции кальцитонина и повышение содержания ПТГ, что, вероятно, связано с дефицитом эстрогенов и тоже способствует усилению костной резорбции. Дополнительные механизмы формирования остеопороза при гипоэстрогении включают снижение абсорбции кальция в кишечнике и дефицит активной формы витамина D.
Лечение. Актуальность восстановления нормального обмена костной ткани у больных с гипогонадизмом крайне высока. Патогенетическим видом лечения в данном случае является эстроген-гестагенная заместительная терапия. Результаты многочисленных исследований доказали, что заместительная гормональная терапия (ЗГТ) предотвращает дальнейшие потери костной массы, нормализует показатели костного обмена и снижает риск переломов костей. При выборе лекарственного средства необходимо учитывать особенности влияния на костную ткань и метаболические эффекты не только его эстрогенного, но и гестагенного компонента.
Защитный эффект вводимых эстрогенов на костную ткань сохраняется лишь в период проведения ЗГТ, а после прекращения лечения вновь отмечается активация костной резорбции. Поэтому заместительная терапия должна проводиться длительно, вплоть до возраста предполагаемой менопаузы. После 50 лет подход к данному контингенту больных должен быть таким же, как и к женщинам постменопаузального возраста.
Остеопенический синдром при гиперпролактинемическом гипогонадизме
Синдром гиперпролактинемии (ГП) – одна из наиболее распространенных нейроэндокринопатий, приводящих в большинстве случаев к развитию гипогонадизма и нарушениям репродуктивной системы. Как известно, у женщин с гиперпролактинемией обычно возникают нарушения менструального цикла: первичная либо вторичная аменорея, опсоменорея, олигоменорея, ановуляция, недостаточность желтого тела, бесплодие.
Наряду с этим длительная гиперпролактинемия нередко сопровождается развитием остеопенического синдрома. Чаще всего снижение МПКТ сохраняется на уровне остеопении, но возможно и развитие тяжелого остеопороза.
Остеопенический синдром у пациенток с гиперпролактинемией может никак не проявляться клинически, что затрудняет своевременную диагностику данного осложнения. В то же время боли в грудном и поясничном отделах позвоночника, периодические боли в тазобедренных суставах могут возникать даже на стадии самых начальных изменений костной ткани и исчезают на фоне лечения агонистами дофамина. Стадии переломов при гиперпролактинемии у женщин репродуктивного возраста практически не наблюдается, хотя при ранней манифестации заболевания (до достижения пика костной массы) либо при высокой индивидуальной активности остеопоротического процесса и этот вариант не исключен.
Патогенез гиперпролактинемической остеопении остается не до конца ясным. Механизм потери костной массы при различных видах гипогонадизма у женщин аналогичен механизму развития постменопаузального остеопороза: он характеризуется преобладанием активности резорбтивных процессов и в его основе лежит недостаток эстрогенов. До последнего времени гиперпролактинемический гипогонадизм считался исключением из этого ряда, но в исследованиях, завершившихся недавно, были получены результаты, свидетельствующие о повышении как резорбции, так и костеобразования у пациентов с гиперпролактинемией.
Наиболее подвержен остеопении при данном синдроме поясничный отдел позвоночника. Определение С-телопептида может применяться для выявления группы пациентов, предрасположенных к развитию остеопенического синдрома при гиперпролактинемическом гипогонадизме. Уровень остеокальцина в крови здоровых женщин и пациенток с гиперпролактинемией представлен на рис. 13.
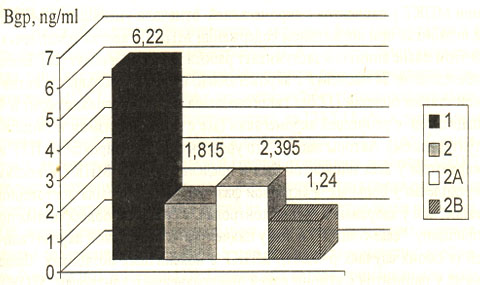
Рис. 13. Уровень остеокальцина в крови здоровых женщин и пациенток с гиперпролактинемией. Примечание: 1 – здоровые женщины; 2 – пациентки с гиперпролактинемией; 2А – пациентки с умеренной гиперпролактинемией (до 3000 Ед/л); 2В – пациентки с высоким уровнем пролактина (более 3000 Ед/л).
Остеопенический синдром при гиперпролактинемии в большинстве случаев не требует назначения дополнительной терапии, и МПКТ восстанавливается на фоне нормопролактинемии, достигнутой путем лечения агонистами дофамина. Важным критерием компенсации является восстановление менструального цикла. В случаях же продолжающейся аменореи и при значительной потере МПКТ (более 2,5 SD) назначают дополнительную терапию, направленную на подавление активности костной резорбции либо на активацию остеогенеза.
Остеопороз при дефиците гормона роста
Недостаточность СТГ в течение длительного времени распознавалась только у детей. Однако в 1989 году было подтверждено наличие дефицита СТГ у взрослых. Большинство случаев недостаточности СТГ, приобретенной во взрослом возрасте, по-видимому, связаны с наличием гипофизарных или окологипофизарных опухолей и являются следствием их лечения.
Влияние СТГ на метаболизм костной ткани не ограничивается препубертатным периодом. В исследованиях на фоне лечения СТГ выявлено повышение в крови уровня остеокальцина. Однако до конца неясен механизм действия СТГ на костную ткань у взрослых. Предполагают, что он реализуется либо через увеличение доступности минералов, либо оказывает непосредственное влияние на пролиферацию остеобластов. В подтверждение первого пути показано, что СТГ, действуя через ИРФ-1, активирует 1α-гидроксилазу почек, превращающую 25ОНD в 1,25 (ОН)2D3, вследствие чего увеличивается абсорбция кальция и фосфатов в кишечнике. Рецепторы к СТГ опосредуют его прямое влияние на пролиферацию остеобластов.
Клинически у больных с недостаточностью СТГ снижается МПКТ, что приводит к развитию остеопении в позвоночнике и в трубчатых костях. Имеется ряд сообщений о снижении МПКТ позвоночника (на 10-20%) и предплечья (на 20-30%) у лиц, перенесших в детстве недостаточность СТГ и у больных с приобретенным во взрослом возрасте гипопитуитаризмом и недостаточностью СТГ.
В немногочисленных работах показано, что при лечении СТГ взрослых с недостаточностью этого гормона увеличивается МПКТ в предплечьях, как в дистальной (трабекулярной), так и в проксимальной (кортикальной) части, что сопровождается увеличением уровня остеокальцина в крови.
Остеопенический синдром при гипопитуитаризме
Сложно выделить главный фактор и определить основной механизм патогенеза при пангипопитуитаризме, когда недостаточность даже одного из тропных гормонов гипофиза через цепь периферических гормонов и местных факторов влечет за собой изменения в метаболизме костной ткани. Наиболее частой причиной гипопитуитаризма являются селлярные и параселлярные опухоли гипофиза, среди которых аденомы гипофиза являются причиной 50-67% случаев гипопитуитаризма, а 10,2% снижения функции гипофиза приходится на краниофарингиомы.
В патогенезе остеопении при гипопитуитаризме можно выделить следующие звенья:
- Эффект недостаточности СТГ.
- Влияние гипогонадотропного гипогонадизма, клиническим проявлением которого у мужчин и женщин чаще манифестирует гипопитуитаризм.
- Изменения в костной ткани при тиреоидной недостаточности, при которой отмечается замедление процессов костного ремоделирования, а также влияние на костную ткань заместительной терапии тиреоидными гормонами.
- Гипокортицизм и воздействие ГК в дозах, применяемых для заместительной терапии.
По данным литературы, в генезе остеопении при пангипопитуитаризме наибольшее значение имеют недостаточность СТГ, выраженность и длительность гипогонадизма, ранний возраст в начале заболевания. Терапия ГК и тиреоидными гормонами в дозах, не превышающих заместительные, не ведет к выраженным нарушениям метаболизма костной ткани. Наиболее значительные нарушения в виде признаков повышенного костного обмена и вторичного гиперпаратиреоза обнаружены у пациентов после удаления краниофарингиом и опухолей, располагавшихся в областях пограничных с гипофизом.
Остеопороз при сахарном диабете
Сахарный диабет (СД) определен Всемирной Организацией Здравоохранения (ВОЗ) как эпидемия неинфекционного заболевания, которое настолько стремительно распространяется по нашей планете и приобрело такие масштабы, что Мировое Сообщество приняло ряд нормативных актов, направленных на борьбу с этим исключительно сложным по своей природе заболеванием, часто имеющим трагические исходы. Драматизм и актуальность проблемы определяются широкой распространенностью СД, высокой смертностью и ранней инвалидизацией больных. Среди поздних осложнений сахарного диабета особое место занимают остеопатии.
Частота выявления остеопороза при сахарном диабете зависит от метода, используемого для оценки плотности костной ткани; снижение плотности подтверждено исследованиями с применением традиционной рентгенографии, компьютерной томографии, простой фотоновой абсорбциометрии, радиограмметрии (радиологическое определение толщины кортикального слоя кости). С помощью перечисленных методов исследования было доказано, что при сахарном диабете типа 1 плотность костной ткани снижается на 10-12%. При сахарном диабете 2 типа потеря плотности костной ткани более выражена и составляет от 10 до 26% в зависимости от возраста, степени избыточной массы тела и длительности заболевания. Снижение плотности костной ткани с потерей 10% и более минеральных компонентов было выявлено у 50% больных сахарным диабетом 1 типа и у 60% СД 2 типа. Более того, уменьшение минерального содержания костной ткани стоп выявляется у 100% больных диабетом старших возрастных групп.
В патогенезе остеопороза при СД можно выделить несколько основных звеньев:
- Абсолютный дефицит инсулина снижает выработку остеобластами коллагена и ЩФ, необходимых для образования костного матрикса и его минерализации. Кроме того, уменьшается стимуляция остеобластов, опосредованная через инсулиноподобные и другие факторы роста.
- Прямое влияние высокой концентрации глюкозы за счет конечных продуктов гликозилирования может усиливать резорбцию кости остеокластами.
- Вследствие сниженной секреции инсулина может иметь место недостаток активных метаболитоа витамина D. Это ведет к снижению всасывания кальция в кишечнике и усилению секреции и активности ПТГ, что, в конечном счете, создает отрицательный баланс кальция в организме и усиливает резорбцию костной ткани.
- Наличие осложнений СД, способствующих развитию остеопении:
- микроангиопатия сосудистого русла костей может нарушать их кровоснабжение;
- гипогонадизм, особенно у пациентов, страдающих СД с раннего возраста, препятствует достижению нормального пика костной массы как у юношей, так и у девушек;
- при СД 1 типа имеет место дефицит СТГ, необходимого для становления пика костной массы и развития скелета;
- при СД 1 типа часто имеет место дефицит массы тела. Это является фактором риска низкой костной массы, что возможно опосредовано через снижение продукции эстрогенов и их метаболизм в жировой ткани.
Основные звенья патогенеза остеопороза у больных СД 1 типа изображены на рис. 14.
Кроме того, такие осложнения СД, как ретинопатия, нейропатия и ангиопатия, ведут к увеличению риска падений и вследствие этого к переломам костей.
У больных сахарным диабетом возможна различная симптоматика поражения опорно-двигательного аппарата. Наиболее тяжелые нарушения развиваются при СД 1 типа (как у детей, так и у взрослых). Системное поражение костной ткани ведет к повышенному риску переломов у этих больных. Факторами риска развития остеопенического синдрома являются манифестация сахарного диабета до 20 лет, длительность заболевания свыше 10 лет, длительная декомпенсация углеводного обмена.
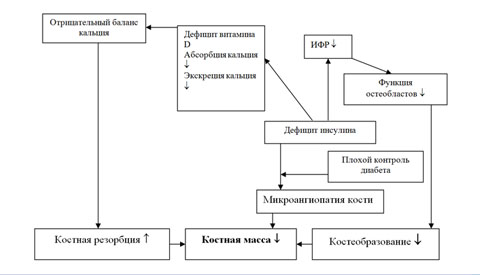
Рис. 14. Схема патогенеза остеопороза у больных сахарным диабетом 1 типа
Диабетическая остеопения относится к поздним осложнениям диабета, и разработка ее профилактики и лечения составляет важную проблему диабетологии, с целью решения которой 207 больным сахарным диабетом (СД) 1 типа (94 мужчины и 113 женщин; больные не имели в анамнезе заболеваний и состояний, приводящих к нарушению МПКТ) проводилось исследование на компьютерном денситометре ДТХ–100 методом рентгеновской количественной абсорбциометрии в периферических отделах лучевой и локтевой костей. Группой сравнения послужили 83 человека, в анамнезе у которых отсутствовали заболевания и состояния, приводящие к изменению МПКТ. Необходимо отметить, что ни у одного из обследуемых больных СД 1 типа не было выявлено переломов в анамнезе. Сравниваемые группы были сопоставимы по полу и возрасту. Оценка состояния фосфорно-кальциевого гомеостаза проводилась по уровню кальция, неорганического фосфора и активности щелочной фосфатазы в сыворотке крови с использованием стандартных наборов «Lachema» (Чехия). Достоверных различий по вышеуказанным показателям у больных СД 1 типа с разной продолжительностью заболевания и разной степенью компенсации углеводного обмена по сравнению с группой здоровых лиц выявлено не было.
При исследовании на компьютерном денситометре ДТХ–100 проводилось определение площади проекции исследуемого участка (Аrea, см2), содержания костного минерала (ВМС – bone mineral content, МСК, грамм), вычислялась проекционная минеральная плотность костей (ВМD – bone mineral density, МПК, г/см2). Показатели, определяющие минерализацию костной ткани, представлялись в виде абсолютных и относительных величин. Абсолютные показатели: МСК в исследуемом дистальном участке предплечья (МСК, грамм) и МПК (г/см2) в дистальном и ультрадистальном участке. Относительные показатели, выраженные в процентах, позволяли сравнивать полученные в ходе исследования результаты со средне-теоретическими нормами определенного возраста (Z-шкала), определять разницу между минеральным содержанием, минеральной плотностью кости больных сахарным диабетом 1 типа и значениями возрастного пика костной массы относительно здоровых лиц (Т-шкала).
Согласно рекомендациям ВОЗ с целью количественной оценки результатов минерального содержания кости показатели выше 90% характеризуются как нормальная минерализация кости, от 80% до 90% (-1 до -1,5 SD) – остеопения I степени, от 70% до 80% (-1,5 до -2,0 SD) – остеопения II степени, от 70% и ниже (-2,0 до -2,5 SD) – остеопения III степени, менее -2,5 SD – остеопороз I степени (без переломов), а наличие при показателе менее -2,5 SD хотя бы одного перелома свидетельствует о тяжелом остеопорозе. Для принятия решений о назначении терапии остеопороза необходимо оценивать Т-критерий (Беневоленская Л. И., Лесняк О. М., 2009 г.).
Во всех таблицах и диаграммах, представленных ниже, МПКТ по Т- и Z- шкалам отражена в абсолютных величинах SD.
В результате проведенного исследования выявлено, что у больных СД 1 типа отмечалось снижение содержания костного минерала по показателям: BMC radius, BMC distal (табл. 8).
Т а б л и ц а 8
Изменения минеральной плотности костной ткани
у больных сахарным диабетом 1 типа, M±m
|
Показатели
|
Здоровые | Больные СД 1 типа |
Р |
| BMC radius, г | 2,07±0,11 | 1,64±0,0 9 | <0,05 |
| BMC ulna, г | 1,21±0,07 | 1,12±0,05 | >0,05 |
| BMC distal, г | 3,18±0,15 | 2,26±0,08 | <0,05 |
| BMC ultra, г | 1,71±0,12 | 1,62±0,06 | >0,05 |
| BMD radius, г/см2 | 0,48±0,03 | 0,34±0,02 | <0,05 |
| BMD ulna, г/см2 | 0,41±0,03 | 0,35±0,02 | >0,05 |
| BMD distal, г/см2 | 0,39±0,02 | 0,23±0,02 | <0,05 |
| BMD ultra, г/см2 | 0,32±0,02 | 0,28±0,01 | <0,05 |
| Area radius, см2 | 3,92±0,17 | 3,85±0,16 | >0,05 |
| Area ulna, см2 | 3,01±0,13 | 2,95±0,17 | >0,05 |
| Area distal, см2 | 7,05±0,11 | 7,01±0,13 | >0,05 |
| Area ultra, см2 | 5,07±0,06 | 5,01±0,03 | >0,05 |
| Z – score (distal BMC percent of agematehed), SD | 0,92±0,08 | – 1,75±0,07 | <0,05 |
| Z – score (distal BMD percent of agematehed), SD | 0,85±0,03 | – 1,31±0,02 | <0,05 |
| Z – score (ultra BMD percent of agematehed), SD | 0,82±0,02 | – 1,44±0,04 | <0,05 |
| T – score (distal BMC percent of reference age), SD | 0,91±0,09 | – 1,93±0,05 | <0,05 |
| T – score (distal BMD percent of reference age), SD | 0,87±0,06 | – 1,87±0,07 | <0,05 |
| T – score (ultra BMD percent of reference age), SD | 0,83±0,05 | – 1,55±0,09 | <0,05 |
Примечание: Р – критерий достоверности при сравнении группы больных сахарным диабетом 1 типа с группой здоровых лиц.
Кроме изменений содержания костного минерала в вышеуказанных участках скелета, подвергалась изменению и проекционная минеральная плотность костей, а именно уровень BMD radius снизился до 0,34±0,02 г/см2 у больных СД 1 типа, а значение BMD distal у данной группы больных составило 0,23±0,02 г/см2. Содержание костного минерала по значению BMC ultra у больных СД 1 типа достоверно не изменилось, а вот проекционная минеральная плотность костей в данном участке скелета достоверно снизилась до 0,28±0,01 г/см2 по сравнению со здоровыми, где она равнялась 0,32±0,02 г/см2 (р<0,05).
У больных СД 1 типа не выявлено достоверного снижения площади проекции исследуемых участков (Area radius, см2, Area ulna, см2, Area distal, см2 и Area ultra, см2) (табл. 7).
Согласно классификации ВОЗ, изменения по Z-score и T-score свидетельствовали о наличии остеопении II степени у больных СД 1 типа.
Существует мнение, что потеря костной массы при сахарном диабете ассоциируется с продолжительностью заболевания. В то же время некоторые исследования не подтверждают эти данные. Чтобы убедиться, влияет ли продолжительность СД 1 типа на изменения МПКТ, все больные были разделены на 3 группы: I-я – больные СД 1 типа с продолжительностью заболевания до 5 лет, II-я группа – от 5 до 10 лет и III-я группа – больные СД 1 типа с продолжительностью заболевания более 10 лет.
Выявлено, что у больных СД 1 типа с продолжительностью заболевания до 5 лет достоверного снижения показателей BMC, ВМD и Area по сравнению со здоровыми лицами не отмечалось. Показатели по Z-score у данной группы больных соответствовали остеопении I степени, а значения по T-score – остеопении II степени (рис. 15).
Таким образом, согласно классификации ВОЗ, у больных СД 1 типа с продолжительностью заболевания до 5 лет выявлялись изменения минеральной плотности костной ткани, характерные для остеопении II степени, что является прогностически неблагоприятным признаком, свидетельствующим о необходимости начала терапии по повышению МПКТ у данной группы больных.
У больных СД 1 типа с продолжительностью заболевания от 5 до 10 лет отмечалось достоверное снижение МПКТ как по Z- score, так и по Т-score (рис. 15), которое свидетельствовало о наличии остеопении II степени.
При продолжительности заболевания более 10 лет у больных СД 1 типа выявлялись достоверные изменения практически по всем показателям, характеризующим минеральную плотность костной ткани, определяемым на компьютерном денситометре ДТХ–100. Так, отмечалось достоверное снижение всех показателей BMC за исключением BMC ultra. Проекционная минеральная плотность костей (BMD) уменьшилась во всех определяемых областях. Кроме того, снизились значения площади проекции исследуемых участков за исключением Area ulna. Изменения по Z-score свидетельствовали об остеопении III степени. МПКТ, оцениваемая по Т-core, также подтверждала наличие у данной группы больных остеопении III степени (рис. 15).
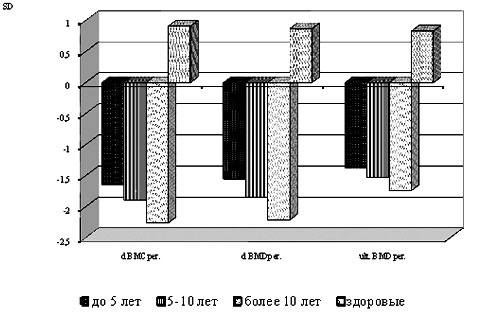
Рис. 15. Изменения минеральной плотности костной ткани у больных сахарным диабетом 1 типа по T-score в зависимости от продолжительности заболевания Примечание: * – р<0,05 – при сравнении каждой из групп больных сахарным диабетом 1 типа с группой здоровых лиц, SD – стандартные отклонения.
Таким образом, у больных СД 1 типа изменения МПКТ зависят от продолжительности заболевания. Но необходимо иметь в виду, что при продолжительности заболевания до 5 лет уже имеются изменения МПКТ, нуждающиеся в фармакологической коррекции, что обязательно необходимо учитывать, подбирая терапию больным СД 1 типа, тем более, в этот период обычно отсутствуют клинические проявления изменений костной системы.
С целью оценки влияния компенсации углеводного обмена на изменения МПКТ все больные СД 1 типа с разной продолжительностью заболевания были разделены по уровню компенсации на субкомпенсированных и декомпенсированных. Больных, находящихся в состоянии компенсации углеводного обмена, среди обследуемых пациентов выявлено не было.
Из сводных данных, представленных в таблице 9, видно, что МПКТ зависит от продолжительности заболевания и компенсации углеводного обмена, и у субкомпенсированных больных эта зависимость выражена отчетливее по сравнению с группой декомпенсированных. Так, при субкомпенсации углеводного обмена с ростом продолжительности СД 1 типа происходило нарастание остеопении на I степень. При декомпенсации углеводного обмена и продолжительности заболевания до 5 лет и от 5 до 10 лет отмечалась остеопения III степени, то есть не было нарастания остеопении. Продолжительность заболевания более 10 лет и сохраняющаяся декомпенсация углеводного обмена уже приводили к развитию остеопороза. В результате проведенного исследования выявлено, что при продолжительности СД 1 типа до 5 лет уже отмечается остеопения III степени.
Т а б л и ц а 9
Изменения минеральной плотности костной ткани в зависимости от продолжительности сахарного диабета 1 типа и компенсации углеводного обмена
| Степень остеопении или остео-пороза |
Продолжительность сахарного диабета 1 типа и
Степень компенсации углеводного обмена |
|||||
|
до 5 лет
|
5-10 лет
|
более 10 лет
|
||||
| субком-пенсация | деком-пенсация | субком-пенсация | деком-пенсация | субком-пенсация | деком-пенсация | |
| остеопения I степени |
остеопения III степени | остеопения II степени | остеопения III степени | остеопения III степени | остеопороз I степени | |
Следовательно, у больных СД 1 типа с целью поддержания нормальных значений МПКТ необходимо строго следить за компенсацией углеводного обмена и назначать препараты, повышающие МПКТ, практически с момента развития заболевания не зависимо от того, в состоянии субкомпенсации или декомпенсации находится больной.
Кроме того, выявлена сильная обратная корреляционная связь между показателем T-score (distal BMC percent of reference age) и уровнем гликемии натощак, а также уровнем постпрандиальной гликемии. Средняя обратная связь выявлена между значением T-score (distal BMC percent of reference age) и продолжительностью: СД, декомпенсации углеводного обмена, IVRT и КДО ЛЖ. Средняя прямая связь выявлена между показателем T-score (distal BMC percent of reference age) и Ve/Va. Выявленная средняя обратная связь между T-score (distal BMC percent of reference age) и показателями IVRT и КДО ЛЖ свидетельствует о том, что чем выраженнее диастолическая дисфункция ЛЖ, тем ниже минеральная плотность костной ткани, что необходимо учитывать, назначая лекарственные препараты больным СД 1 типа как с диастолической дисфункцией, так и с остеопенией или остеопорозом и особенно при их сочетании у одного больного.
Таблица 10
Корреляция между клиническим состоянием больных сахарным диабетом 1 типа и показателем, характеризующим минеральную плотность костной ткани
|
Клинические |
T-score (distal BMC percent of reference age), SD | |||
| Больные СД | Здоровые | |||
| r | p | r | p | |
| Продолжительность СД | – 0,45 | 0,02 | – | – |
| Продолжительность субкомпенсации | – 0,29 | 0,15 | – | – |
| Продолжительность декомпенсации | – 0,57 | 0,04 | – | – |
| Уровень глюкозы натощак | – 0,75 | 0,03 | – | – |
| Уровень постпрандиальной гликемии | – 0,91 | 0,01 | – | – |
| IVRT | – 0,35 | 0,03 | – 0,11 | 0,04 |
| КДО ЛЖ | – 0,43 | 0,02 | – 0,21 | 0,04 |
| Ve/Va | 0,55 | 0,02 | 0,27 | 0,03 |
Примечание: r – коэффициент корреляции, p – критерий достоверности коэффициента корреляции.
Таким образом, можно предположить, что коррекция минеральной плотности костной ткани у больных СД 1 типа будет приводить к улучшению диастолической функции ЛЖ.
С целью коррекции МПКТ больные СД 1 типа в течение года принимали препарат – карбонат кальция с витамином Д3 (“СаД3 Никомед Форте”) по 1 таблетке 1 раз в день и соблюдали диету, богатую кальцием (1 литр нежирного кефира – ежедневно). На фоне вышеуказанной терапии и субкомпенсации углеводного обмена остеопения со II степени снизилась до I степени, что также было отмечено в группе больных СД 1 типа с компенсацией углеводного обмена, которые в течение года дополнительное лечение, направленное на повышение минеральной плотности костной ткани, не получали. У больных СД 1 типа, получавших диету, богатую кальцием, и препарат “СаД3 Никомед Форте” по 1 таблетке 1 раз в день и строго компенсирующих состояние углеводного обмена в течение года, значения по Z-score и Т-score свидетельствовали о нормальной минеральной плотности костной ткани. По остальным анализируемым показателям, оценивающим МПКТ, данная группа больных СД 1 типа не отличалась от здоровых лиц.
Следовательно, только назначение диеты и препаратов, повышающих минеральную плотность костной ткани, как и строгая компенсация углеводного обмена без дополнительного вышеуказанного лечения, не могут привести к нормализации минеральной плотности костной ткани, хотя степень остеопении снижается. Таким образом, необходима строгая компенсация углеводного обмена и назначение препаратов, повышающих МПКТ, с момента выявления сахарного диабета с целью предотвращения развития переломов и инвалидизации больных.
4.4.Остеопороз при желудочно-кишечной патологии
Р. Т. Галеева
Сокращения:
АЛС – антацидные лекарственные средства
ОЩФ – общая щелочная фосфатаза
ПФК – площадь под фармакокинетической кривой
ЩФ – щелочная фосфатаза
ЭГДС – эзофагогастродуоденоскопия
ЯБЖ – язвенная болезнь желудка
ЯБДК – язвенная болезнь двенадцатиперстной кишки
HP – Helicobaсter pylori
Остеопороз часто наблюдается у лиц с хроническими заболеваниями желудочно-кишечного тракта во всех возрастных группах. В большинстве случаев клинические признаки первичной патологии умеренно выражены, однако иногда первым проявлением является остеопороз или остеомаляция. Дифференцировать остеопороз и остеомаляцию у таких пациентов довольно трудно, так как возможно сочетание этих двух нарушений. Поскольку ныне большое внимание уделяется нормальному питанию, особенно употреблению витамина D, вероятность развития остеомаляции у таких больных ниже, чем развитие остеопороза. Небольшое снижение уровня кальция и существенное снижение фосфата в сыворотке крови, повышение уровня общей или костноспецифической щелочной фосфатазы служат диагностическими признаками для выявления остеомаляции.
Основные причины остеопороза при заболеваниях желудочно-кишечного тракта:
- Все обычные факторы риска (возраст, пол, курение, употребление алкоголя).
- Воспалительные заболевания кишечника.
- Хронические заболевания печени.
- Целиакия.
- Употребление глюкокортикостероидов в лечении желудочно-кишечной патологии.
- Недостаточность поджелудочной железы.
- Мальабсорбция.
- Резекция желудка/кишечника.
При большинстве заболеваний ЖКТ, печени и поджелудочной железы нарушаются всасывание и обмен витамина D и его метаболитов, а также имеет место мальабсорбция кальция. Преобладание того или иного типа метаболической остеопатии определяется длительностью, характером патологического процесса, выраженностью синдрома мальабсорбции. Так, остеопения реже встречается при заболеваниях поджелудочной железы и достигает 50-70% у пациентов с энтеропатиями, резецированным желудком, после операций обводного анастомозирования при хирургическом лечении ожирения. Костные нарушения при алкоголизме прежде всего можно связать с прямым подавляющим действием этанола на костеобразование, а также с развитием анорексии при алкоголизме, панкреатита и в ряде случаев с циррозом печени. Также может иметь значение нарушение метаболизма кортизола в печени и развитие метаболического гиперкортицизма и гипогонадизма.
Остеопороз при воспалительных заболеваниях кишечника
Распространенность снижения плотности минералов кости у пациентов с болезнью Крона и хроническим язвенным колитом, по данным Всемирной организации гастроэнтерологов (ВОГ-ОМGE), варьирует в широких пределах, но обычно поражает около 25% пациентов. Использование глюкокортикостероидов (ГКС) в лечении воспалительных заболеваний кишечника играют важную роль в формировании остеопении/остеопороза. Кроме того, ряд авторов в качестве механизмов потери костной ткани предлагают рассматривать кишечную мальабсорбцию кальция, недостаточное питание, дефицит витамина D и высокие циркулирующие уровни провоспалительных цитокинов, таких как интерлейкин-1, интерлейкин-6 и фактор некроза опухоли [Robinson R. J., al-Azzawi F., 1998; Scott E. M., Gaywood I., Scott B. B., 2000].
Снижение минеральной плотности костной ткани при указанной патологии представляет собой клиническую проблему, поскольку у данных пациентов на 40% увеличивается количество переломов. Потеря костной массы составляет 3% в год у пациентов с заболеваниями кишечника, не принимающих ГКС, и 6% в год у тех пациентов, которые получают ГКС (при равном риске для мужчин и женщин). У 30-40% больных с заболеваниями кишечника, постоянно принимающих ГКС, имеются переломы. При этом распространенность и выраженность остеопении/остеопороза у пациентов с язвенным колитом меньше, чем у пациентов с болезнью Крона (данные ВОГ-ОМGE). Наиболее быстрая потеря костной массы происходит в первый год регулярного приема ГКС в одинаковой степени в поясничных позвонках и шейке бедра. В то же время потеря костной ткани при болезни Крона выявляется независимо от терапии ГКС, а при неспецифическом язвенном колите последняя, по-видимому, играет важную роль.
Остеопороз при болезни печени
При заболеваниях печени и желчных путей случаи нарушения костного метаболизма достаточно редки, так как печень обладает огромными резервными возможностями. Костные нарушения при алкогольном поражении печени скорее можно связать с прямым воздействием этанола на кость, чем с поражением печени. Тем не менее, при тяжелых заболеваниях печени, таких как первичный билиарный цирроз, гемохроматоз, аутоиммунный гепатит, трансплантация печени (в том числе вследствие применения ГКС, цитостатиков), остеопения имеет место [Eastell R., Dickson E. R., Hodgson S., Wiesner R. H., 1991]. Факторами, способствующими нарушению минерального и костного обмена, являются: анорексия, нарушение абсорбции поступающего с пищей витамина D и его метаболитов; потери витамина D с калом и мочой; связывание витамина D и его метаболитов желчными кислотами; нарушение 25-гидроксилирования витамина D в печени [Hay J. E., 1995; Rouillard S., Lane N. E., 2001]. Остеопения и остеопороз с низким уровнем костного метаболизма встречается у таких больных несколько чаще, чем остеомаляция.
Первичный билиарный цирроз (ПБЦ) – хроническое гранулематозное деструктивное воспалительное заболевание междольковых и септальных желчных протоков аутоиммунной природы, приводящее к развитию длительного холестаза, а на поздних стадиях к формированию цирроза. С прогрессированием холестаза наблюдаются стеаторея, остеопороз, а затем остеомаляция, ксерофтальмия и геморрагический синдром. Появляются хрупкость тел позвонков, кифозы и патологические переломы.
Остеопороз при целиакии
Целиакия (глютеновая энтеропатия, нетропическая спру) – заболевание, которое характеризуется атрофией ворсинок эпителия тонкой кишки в ответ на белок некоторых злаков – глиадин – и проявляется синдромом мальабсорбции различной степени выраженности. Остеопороз выявляется у 50% пациентов с целиакией, поэтому данное заболевание всегда надо иметь в виду при объяснении причины остеопороза даже в отсутствие кишечных проявлений.
Большинство пациентов, страдающих той или иной формой целиакии, имеют синдром мальабсорбции, который приводит к развитию гипотрофии и многих других метаболических расстройств. Страдают все виды обмена, в первую очередь белковый обмен. С одной стороны, мальабсорбция сама по себе может привести к значительной белковой недостаточности, с другой стороны, повреждение слизистой оболочки тонкой кишки нередко приводит к развитию вторичной экссудативной энтеропатии. В результате выраженной гипопротеинемии и гипоальбуминемии развиваются безбелковые отеки. Формируется полигиповитаминоз. Иногда, при поражении только двенадцатиперстной кишки и проксимальной части тощей кишки, целиакия может проявляться лишь изолированным дефицитом железа или фолиевой кислоты (без желудочно-кишечных симптомов). Витаминная и минеральная недостаточности могут привести к остеомаляции и хондропатии. Нарушение всасывания кальция и витамина D приводит к развитию остеопороза и формированию рахитоподобных деформаций костной системы. В группах больных целиакией могут быть представлены компрессия позвонков с бессимптомными переломами, кифосколиоз, межпозвонковые грыжи и другие признаки заболеваний костей и хрящей. Исследование зубов всегда выявляет их изменение. В большей части случаев целиакия может быть выявлена стоматологом по глубокому повреждению зубной эмали, симметрично расположенным изменениям цвета зубов и текстуры поверхности.
Дифференциальный диагноз необходимо проводить в случае нарушения фосфорно-кальциевого обмена с развитием тяжелого рахитоподобного синдрома, деформацией костей и низкорослостью. Известны случаи тяжелой гипокальциемии с развитием судорожного синдрома, в связи с чем возникали подозрения на эпилепсию. Лица с гипокальциурией или гиперпаратиреозом при нормальном уровне кальция в крови и поражениях костей, а также лица с необъяснимой гипокальциемией и вторичным гипертиреозом должны быть обследованы на наличие мальабсорбции и целиакии. В атипичных случаях целиакия проявляется каким-либо отдельным симптомом. Известен случай целиакии, которая проявлялась диффузным остеопорозом, и единственным симптомом были боли в ногах. В этих случаях диагноз подтверждается гистологически и серологически.
Остеопороз при синдроме мальабсорбции
Мальабсорбция (синдром нарушенного всасывания) характеризуется расстройством всасывания в тонкой кишке одного или нескольких питательных веществ и возникновением нарушения обменных процессов. Выделяют наследственно обусловленный и приобретенный синдром нарушенного всасывания. Кишечные проявления мальабсорбции: диарея, полифекалия, стеаторея, креаторея, амилорея. В итоге имеет место нарушение белкового, углеводного, жирового, витаминного, минерального и водно-солевого обмена веществ. Синдром мальабсорбции – это в том числе нарушение переваривания пищевых веществ вследствие дефицита пищеварительных ферментов. Причем наблюдается либо отсутствие синтеза одного или нескольких ферментов, либо снижение их активности, либо изменение биохимических реакций, влияющих на ферментативную активность. Среди врожденных ферментопатий наиболее часто встречается недостаточность дисахаридаз (лактазы, сахаразы, изомальтазы и др.), пептидаз (глютеновая энтеропатия), энтерокиназы. Приобретенные ферментопатии наблюдаются при хроническом энтерите, болезни Крона, дивертикулезе с дивертикулитом, резекции тонкой кишки, заболеваниях других органов пищеварения (панкреатит, гепатит, цирроз печени) и органов эндокринной системы (диабет, гипертиреоз), а также при приеме некоторых лекарственных препаратов (антибиотики, цитостатики и др.), облучении.
Патологические изменения тонкой кишки являются важным фактором нарушения метаболизма кальция и развития остеопенического синдрома у детей и подростков. Дефицит кальция нарушает минерализацию скелета, снижает толерантность к воздействию травмы, повышает риск развития остеопороза и особенно опасен в период интенсивного роста, когда происходит формирование костной ткани. Костные нарушения у больных с хроническими заболеваниями тонкой кишки нередко протекают скрыто, без отчетливой симптоматики. Однако у ряда больных при синдроме мальабсорбции отмечаются боли в костях, усиливающиеся при физической нагрузке; мышечная слабость, скованность движений по утрам, деформация костей и спонтанные переломы трубчатых костей, потливость, быстрая утомляемость, нарушение трофики зубной эмали. Запоздалая диагностика приводит к различным осложнениям, самыми серьезными из которых являются деформация костей, спонтанные переломы, субнанизм.
Изучение биохимических параметров кальция и фосфора в сыворотке крови показывает достоверное снижение уровня кальция и фосфора при всех формах хронических заболеваний тонкой кишки. Параллельно отмечается значительная замедленность экскреции с мочой данных показателей независимо от формы заболевания. Кроме того, резко возрастает активность паратиреоидного гормона и активность щелочной фосфатазы, что свидетельствует об ускоренном формировании кости в процессе дифференциации остеобластов при тяжелых формах синдрома мальабсорбции. По данным денситометрии у больных с синдромом нарушенного всасывания отмечается резкое снижение минеральной насыщенности костной ткани, которое выражается в уменьшении массы компактного и губчатого вещества, толщины кортикального слоя.
Остеопороз при гастроинтестинальных резекциях
Гастрэктомия – фактор риска развития вторичного остеопороза. Наибольшая вероятность возникновения мальбсорбции и остеопороза наблюдается при тотальной гастрэктомии или при операции II типа по Бильроту. Отдаленные метаболические эффекты неполной гастрэктомии до конца не изучены. Отмечено нарушение абсорбции кальция в кишечнике. В то же время могут играть роль нарушения, связанные не только с кальцием, но и с магнием.
Развитие остеопатии после операций на желудке обусловлено рядом факторов: самоограничением в ежедневном наборе продуктов во избежание диареи и демпинг-синдрома, быстрым транзитом пищи, анатомическими изменениями в желудочно-кишечном тракте, приводящими к нарушению всасывания витамина D и его метаболитов (истощение фосфатов ввиду интенсивного применения фосфатсвязывающих антацидов). Остеопения редко обнаруживается раньше 5 лет после операции на желудке. Начало постепенное и часто ассоциируется с остеопорозом. Однако с течением времени дефицит витамина D становится более выраженным, у пациентов появляются диффузные боли в костях, мышечная слабость, нарушения походки, а также биохимические и рентгенологические признаки остеомаляции. Тем не менее, у ряда больных развитие остеопении может протекать по типу остеопороза с низким костным обменом. В этих случаях патогенетическим фактором может быть дефицит белка и других питательных веществ. Большинство больных нуждается в пожизненном применении препаратов витамина D под контролем уровня кальция и почечной функции.
После резекции кишечника или наложения обходных анастомозов нарушается всасывание и кальция, и витамина D, у части больных могут увеличиваться эндогенные потери кальция и витамина D с фекалиями. Степень выраженности остеопатии зависит от зоны и протяженности резекции. После обводного анастомозирования, выполнявшегося с целью лечения ожирения, остеопатия развивается даже в тех случаях, когда сразу после операции с целью профилактики был назначен витамин D.
Остеопороз при недостаточности поджелудочной железы
При панкреатонедостаточности, несмотря на жировую мальабсорбцию истеаторею, метаболические костные нарушения не так часты у данного контингента больных. В определенной степени этот факт объясняется неповрежденностью слизистой оболочки кишечника. Тем не менее у таких пациентов имеется риск развития нарушения абсорбции кальция и витамина D. Злоупотребление алкоголем, столь нередкое среди пациентов с панкреатитом, может способствовать развитию остеопении.
Остеопения/остеопороз может развиваться также вследствие панкреатической обструкции, хронического воспаления или муковисцидоза. Во всех подобных случаях наблюдается мальабсорбция, которая в тяжелой стадии способствует развитию остеомаляции. Также может определяться вторичный гиперпаратиреоз. Поскольку сегодня эффективность лечения пациентов с муковисцидозом существенно возросла, а срок их выживаемости пролонгирован, остеопороз, вероятно, станет вызывать более пристальное внимание в отношении данной группы больных.
Диагностический алгоритм для пациента с остеопенией/остеопорозом и желудочно-кишечным/печеночным заболеванием:
- Диагностика и лечение основных или сопутствующих заболеваний желудочно-кишечного тракта и печени.
- Исследование уровня кальция, фосфора, щелочной фосфатазы, трансаминаз в сыворотке крови.
- Исследование функции щитовидных желез.
- Исследование уровня паратиреоидного гормона.
- Исследование уровня половых гормонов (эстрадиол у женщин, тестостерон у мужчин).
- Денситометрия.
Среди наиболее часто встречающихся заболеваний желудочно-кишечного тракта у детей необходимо отметить язвенную болезнь двенадцатиперстной кишки. Это одно из самых распространенных заболеваний органов пищеварения, 50% пациентов гастроэнтерологического отделения в городском стационаре составляют больные с язвенными поражениями желудка или 12-перстной кишки. Как самостоятельное хроническое заболевание развивается в результате нарушения равновесия между агрессивными факторами (гиперацидность, гастродуоденальная дисмоторика, хеликобактерная инфекция, нарушение микроциркуляции) и защитными возможностями слизистой (муцинопродукция, достаточное кровоснабжение, способность к активной регенерации). Клиническая картина язвенной болезни различная и зависит от локализации язвенного дефекта. Осложнения при данной патологии нередки и часто не удается найти связь с длительностью заболевания, частотой рецидивов, проводимым лечением. Среди известных осложнений можно назвать кровотечение, перфорацию, пенетрацию, стеноз привратника, малигнизацию, реактивный гепатит и реактивный панкреатит. В последние годы все возрастающее внимание уделяется факторам формирования остеопении и остеопороза на фоне язвенной болезни двенадцатиперстной кишки. Особый интерес в этом свете представляют исследования метаболизма кальция и фосфора на фоне данной патологии.
Патогенез остеопении/остеопороза при язвенной болезни
Основным источником кальция и фосфора для человека является биосфера, в организме они усваиваются с пищевыми продуктами и водой [Шицкова А. П., 1984 г.; Matcovic V., Heaney R.P., 1992]. Ряд авторов указывает на необходимость правильного соотношения в пище кальция и фосфора для полноценного их усвоения, отмечая взаимное конкурирующее влияние биоэлементов, а также отрицательное влияние на процессы всасывания избытка в пище фитиновой и щавелевой кислот [Ковалев Д. И., 1991 г.]. На содержание кальция и фосфора в организме оказывает влияние рацион питания, его сбалансированность по белкам, жирам, углеводам, витаминам.
Всасывание, секреция и реабсорбция кальция и фосфора в желудке и кишечнике является важными компонентами гомеостаза их в организме [Плежева Я. Б., 1999 г.]. Экскреция кальция и фосфора также осуществляется преимущественно через пищеварительный канал. Особенность двенадцатиперстной кишки заключается в одновременном осуществлении ею барьерно-защитной и всасывающей функции. Их нарушение происходит при любых расстройствах со стороны желудочно-кишечного тракта [Котова С. М., Горделадзе А. С., Карлова Н. А., 1997 г.; Audran M., 1994]. Всасывание кальция и фосфора осуществляется в проксимальном отделе тонкой кишки, кальция – преимущественно в двенадцатиперстной кишке.
Важным фактором, определяющим активность процесса всасывания кальция и фосфора, является не только содержание их в поступающих пищевых веществах, но также уровень и степень активности в организме метаболитов витамина D, особенно кальцитриола (1,25(ОН)2D3), стимулирующего образование кальцийсвязывающего белка в энтероцитах [Дамбахер М. А., Шахт Е., 1996 г.; Рожинская Л. Я., 1996 г.; Fraser D. R., 1995; Peacock M., 1995]. Всасывание фосфора происходит за счет системы Nа-зависимого активного транспорта, не исключается возможность поступления его вместе с кальцием под влиянием кальцитриола [Родионова С. С., Рожинская Л. Я., Марова Е. И., 1997 г.; De Luca H. F., 1993]. Ряд авторов указывает, что у части детей с ЯБ клинически имеет место дефицит витамина D. Дефицит витамина D связан не только с меньшим поступлением его с пищей, но и снижением кожного синтеза. Этому способствует недостаточное пребывание на свежем воздухе, особенно у городских детей из регионов с атмосферным загрязнением и климатических поясов с небольшим количеством солнечных дней [Запруднов А. М., 1996 г.; Ласфарг Ж., 1996 г.].
Воспалительные, дистрофические и атрофические изменения со стороны желудка и двенадцатиперстной кишки при их патологии неизбежно сопровождаются нарушением всасывания кальция и фосфора [Заславская Т. Н., 1991 г.; Gallagher J. C., Riggs B. L. et al., 1979]. У больных с ЯБ морфологические изменения желудка и двенадцатиперстной кишки многообразны. Выявляются различные формы гастритов и дуоденитов от поверхностного до атрофического, максимальная выраженность атрофии определяется в периульцерозной зоне [Федив А. И., Гайдичук В. С., Троян Н. Ф., 1998 г.; Prieto J., Polanco J. et al., 1992]. Характерно исчезновение бокаловидных клеток, разрастание соединительной ткани, отек стромы. Даже при наличии язвенного рубца в течение длительного времени сохраняется воспаление на фоне необратимых атрофических и фиброзных изменений слизистой оболочки. В фазе ремиссии исчезают дистрофические изменения в поверхностном и железистом эпителии, но структурные изменения слизистой сохраняются. Рецидивы заболевания чаще возникают у больных с выраженными атрофическими и дегенеративными изменениями слизистой оболочки. Изучено повреждающее действие высокой кислотности желудочного сока на энтероциты, способствующее нарушению процессов всасывания. Описано прямое повреждающее действие НР на участках “желудочной метаплазии” в двенадцатиперстной кишке [Григорьев П. Я., Яковенко Э. П., 1998 г.; Татаринов П. А., Грацианская А. Н., 1998 г.]. У детей с ЯБ нарушение процессов желчеотделения может снижать всасывание витамина D и кальция в кишечнике. Компенсаторной реакцией на снижение поступления кальция в организм является активация паратиреоидного гормона с последующей костной резорбцией, на что указывается в нескольких публикациях [Родионова С. С., Рожинская Л. Я., Марова Е. И., 1997 г.; Silver J., Naven-Manu T. еt al., 1984; Jones G., Sambrook P. N., 1994].
В результате экспериментальных исследований выявлено снижение общей абсорбционной способности тонкой кишки у больных с ЯБ, особенно в фазе обострения заболевания. Отмечается также, что в процессе лечения антацидными препаратами происходит прямое взаимодействие белка пищи и лекарственного средства. Наиболее выраженный адсорбирующий эффект регистрировался исследователями в случае применения алюминийсодержащих антацидов [Таболин В. А., Бельмер С. В., 1996 г.].
В современной литературе отражена роль кальция и фосфора в патогенетических механизмах ЯБ, их содержание в различных средах организма [Шапкина О. А., 1994 г.]. В ряде публикаций приведены данные о том, что кальций в главных и париетальных клетках слизистой оболочки желудка играет ключевую роль в регуляции их функциональной активности [Бирг Н. А., 1994 г.; Трифонов В. Д., 1998 г.]. Ионы кальция участвуют в освобождении ацетилхолина из пресинаптических терминалей, гастрина из G-клеток и гистамина из гистаминоцитов посредством нейтрализации кальцием анионных групп на мембранах секреторных пузырьков и на внутренней поверхности цитоплазматической мембраны с последующим слиянием мембранных структур, что приводит к выходу медиаторов и гормонов. Хотя непосредственная стимуляция париетальной клетки гистамином (основной путь стимуляции кислоты посредством связывания Н2-рецепторов с гистамином и активация аденилатциклазы с последующим метаболизмом цАМФ) не требует наличия кальция. Ионы кальция проявляют выраженное стимулирующее действие в отношении секреции пепсина, ускоряя его выход из клеток. Таким образом, кальций является важным компонентом ульцерогенеза [Устянский Е. А., 1981 г.].
Проведенные научные исследования доказали, что ключевым фактором пролиферативной программы клетки являются ионы кальция независимо от типа клеточной популяции. Выявлено, что кальций повышает чувствительность клетки к стимулирующему пролиферацию агенту, индуцирует синтез ДНК. Длительная гиперкальциемия сопровождается увеличением количества антральных G-клеток. Внутриклеточный кальций стимулирует сократительную способность миоцитов желудка. Нарушение кальциевого обмена может приводить к повреждению и гибели клеток.
Учитывая роль кальция в механизмах кислотообразования и пепсинообразования у больных с ЯБ, оправдан интерес к изучению его содержания в различных средах организма. Есть работы, посвященные определению его содержания в крови, желудочном соке и слюнном секрете больных с ЯБ [Омарова В. А., 1980 г.; Устянский Е. А., 1981 г.; Шапкина О. А., 1994 г.].
Изменения в крови при ЯБ принято считать неспецифическими, характерными для общего адаптационного синдрома, отражающими активацию симпатоадреналовой, гипофизарно-надпочечниковой систем на фоне мобилизации процессов энергообразования. Большинство авторов не выявляли каких-либо изменений содержания кальция в крови пациентов в различные фазы язвенного процесса. Указывается на возможное повышение результатов, при синдроме рвоты у нескольких больных с ЯБДК регистрировалось его снижение. В процессе рубцевания язвенных дефектов многие исследователи отмечали положительную динамику показателей кальция крови [Ивашкин В. Т., 1981 г.; Ипатов Ю. П. с соавт., 1997 г.].
Данные литературы о содержании кальция в желудочном секрете у больных с ЯБДК немногочисленны и противоречивы. В одних публикациях высказывается мнение, что потеря кальция из слизистой оболочки в желудочный секрет влечет за собой угнетение секретообразования [Омарова О. А., 1980 г.; Устянский Е. А., 1981 г.]. Некоторые авторы считают, что кальций регулирует продукцию ионов водорода и принимает участие в продукции кислоты в желудке, то есть высокое содержание макроэлемента в желудочном соке сопровождается увеличением кислотности [Ивашкин В. Т., 1981 г.]. В работе О. А. Шапкиной (1994 г.) показано умеренное увеличение содержания кальция в базальной и стимулированной порции желудочного сока детей с ЯБДК, причем наибольшие показатели выявлялись в обострении заболевания, при множественном язвенном поражении двенадцатиперстной кишки, а также в случае осложнения кишечным кровотечением.
В клинической литературе имеются единичные работы, посвященные изучению содержания кальция в слюнном секрете при ЯБДК как у взрослых, так и у детей [Омарова О. А., 1980 г.; Шапкина О. А., 1994 г.; Ипатов Ю. П., Комарова Л. Г., 1997 г.]. Известно, что секрет слюнных желез содержит эссенциальные биоэлементы, в том числе кальций. Слюнная секреция участвует в поддержании гомеостаза кальция в организме. Результаты проведенных исследований слюны также разноречивы – отмечалось как небольшое уменьшение содержания кальция в слюне, так и увеличение показателей. Некоторые авторы выявляли зависимость содержания кальция в слюне от уровня кислотообразования и содержания кальция в желудочном секрете [Трифонов В. Д., 1998 г.]. Наиболее убедительны сведения, показывающие зависимость уровня кальция слюны от активности и проницаемости гематосаливарного барьера [Ипатов Ю. П. с соавт., 1997 г.]. Функциональное состояние барьера характеризуется математической величиной, равной соотношению концентрации кальция крови к содержанию кальция в слюнном секрете (коэффициент распределения, КР), что отражает его проницаемость. Коэффициент распределения, равный единице, иллюстрирует пассивный транспорт иона, выше единицы – высокую активность энергетических затрат при прохождении барьера и низкую его проницаемость. Авторы отмечали некоторое повышение содержания кальция в слюнном секрете в период обострения заболевания при снижении коэффициента распределения, что расценивалось ими как снижение активности гематосаливарного барьера.
Представляет интерес также содержание гормонов эндокринных желез у больных с ЯБДК, влияющих на метаболические процессы в костной ткани. В патогенетических механизмах язвообразования в период гормонального становления велика роль нарушения взаимоотношения между гормонами надпочечников (повышение глюкокортикоидов и снижение минералокортикоидов) [Минушкин О. Н., Зверков И. В., 1995 г.]. В свою очередь, глюкокортикоиды оказывают сложное влияние на костное формирование – в физиологических дозах стимулируют костный коллагеновый синтез, а при избытке эндогенного происхождения и длительном действии – подавляют его путем уменьшения репликации преостеобластов. Глюкокортикоиды уменьшают кальциевую абсорбцию, повышая секрецию паратиреоидного гормона [Рожинская Л. Я., 1996 г.; Raisz L. G., 1988]. Паратиреоидный гормон стимулирует базальную гиперпродукцию соляной кислоты на фоне гиперкальциемии, что было подтверждено в экспериментальных работах [Калинин А. П., 1997 г.]. Авторы отмечают, что 15-25% больных гиперпаратиреозом страдают пeптической язвой двенадцатиперстной кишки. Основное действие гормона – поддержание гомеостаза кальция, главный его стимулятор – снижение уровня кальция крови. Паратиреоидный гормон стимулирует остеокластическую костную резорбцию и остеоцитарный остеолиз, но в низких дозах оказывает стимулирующее действие на образование кости [Dempster D. W., 1993]. Стимуляторами паратиреоидного гормона выступают также гистамин и секретин, участвующие в механизмах язвообразования.
У детей с ЯБДК в период обострения наблюдается повышение в крови соматотропного гормона. Данный эффект можно объяснить его мощным анаболическим действием. В эксперименте соматотропный гормон улучшает слизеобразование в желудке, повышает антипептические свойства крови посредством стимуляции минералокортикоидов, снижает уровень желудочной секреции и кислотности сока. Прямое влияние на кость соматотропного гормона лимитировано низким уровнем рецепторов в костной ткани, но в некоторых работах отмечено влияние его на костное формирование через инсулиноподобный ростовой фактор 1, влияющий на поддержание нормальной скелетной массы. Соматотропный гормон стимулирует всасывание кальция в кишечнике [Родионова С. С., 1991 г.; Рожинскакя Л. Я., 1996 г.].
Возможные механизмы торможения кислотоообразования у больных с ЯБ могут быть связаны с действием кальцитонина, тем более что на клеточной поверхности секреторных клеток желудка обнаружены его специфические рецепторы [Франке Ю., Рунге Г., 1995 г.]. Предполагается блокирование им поступления кальция в секреторные клетки. Следствием этих процессов является снижение секреции соляной кислоты и пепсина в базальной и стимулированной порции желудочного сока [Badurski J., 1993]. Выделение кальцитонина стимулируется гастрином, секретином. В то же время кальцитонин блокирует остеолиз, стимулированный паратиреодным гормоном, угнетает и уменьшает количество остеобластов, оказывает гипокальциемический эффект [Делмас П. Д., 1995 г.; Jonston C. C., 1992].
В литературе отмечено снижение содержания в крови тиреотропного гормона у детей в фазе обострения ЯБДК с последующим повышением в период рубцевания язвенного дефекта [Арбузова В. Г., 1998 г.]. Данные о содержании трийодтиронина и тироксина противоречивы. Однако повышение трийодтиронина чаще расценивают как компенсаторную реакцию, направленную на активацию репаративных процессов. Показатели тироксина чаще близки к значениям здоровых детей, иногда отмечается некоторое снижение показателей. Тироксин и трийодтиронин участвуют в регуляции желудочной секреции, обеспечении структурной целостности слизистой оболочки желудочно-кишечного тракта. Тироксин оказывает прямое действие на образование хряща и стимулирует костную резорбцию [Рожинская Л. Я., 1996 г.].
Эстрогены снижают секрецию желудочного сока, повышают резистентность слизистой оболочки желудка по отношению к агрессивным факторам; действие андрогенов обратное. Половые гормоны предотвращают потери костной ткани, стимулируют набор пика костной массы, оказывая влияние на метаболизм кальцитриола [Рожинская Л. Я., 1996 г.; Raisz L. G., 1988].
Патогенетические механизмы ЯБДК тесно связаны с многочисленными гормонами, влияющими на метаболические костные процессы, всасывание кальция и фосфора в кишечнике, функциональную активность метаболитов витамина D. Действие гормонов многообразно и часто разнонаправлено. Их взаимное влияние особенно значимо в период интенсивного роста скелета. Механизмы кислотообразования, пепсинообразования, мышечного сокращения желудка и двенадцатиперстной кишки и рубцевания язвенного дефекта проходят с активным участием кальция. Процессы всасывания в тонкой кишке кальция и фосфора у детей с ЯБДК могут быть нарушены.
Дети с ЯБДК в препубертатный и пубертатный период не отстают в физическом развитии, а иногда даже обгоняют сверстников, но при длительном течении заболевания физическое развитие их может быть ниже средних значений. Однако изучение минеральной массы и минеральной плотности костной системы у детей с ЯБДК не проводилось. В доступной отечественной и зарубежной литературе нам встретилась лишь одна работа, отражающая связь заболеваний скелета (сколиозы) с инфицированностью детей НР [Иванов А. В., 1998 г.].
Таким образом, клинические проявления вторичного остеопороза на фоне различных заболеваний ЖКТ имеют свои особенности, которые необходимо учитывать при лечении и профилактике этой патологии. Необходимо обязательное назначение остеопротекторов по общей схеме лечения, но есть и свои особенности.
К сожалению, патогенетическое лечение остеопороза на фоне желудочно-кишечных заболеваний имеет существенные ограничения. Гормональная заместительная терапия с учетом возможных осложнений может быть рекомендована только для женщин после менопаузы, которые принимают глюкокортикостероиды по основному заболеванию. Назначение селективных модуляторов эстрогеновых рецепторов полезно для мужчин с низким уровнем эстрогенов. Кальциотонин используется только с целью снижения риска переломов позвоночника, но не для другой локализации. Причем, он особенно показан при неэффективности препаратов первого ряда (бисфосфонаты) или при толерантности к ним. Применение паратиреоидного гормона оказывается очень дорогим, поэтому назначается только в тяжелых случаях. Использование бисфосфонатов возможно при всех случаях, когда у пациента нет гиперацидных заболеваний. Но при их назначении существует риск приобретения заболеваний желудочно-кишечного тракта, протекающих с повышенным кислотообразованием (эзофагиты, гастриты, язвенная болезнь). Итого, выбор невелик. Поэтому особое внимание должно уделяться профилактическим мероприятиям, как по основному заболеванию, так и по развитию остеопороза на их фоне.
4.4.1. Состояние костной системы у детей с ЯБДК в зависимости от клинического течения
Р. Т. Галеева, Е. Б. Шурыгина
Язвенная болезнь двенадцатиперстной кишки (ЯБДК) занимает одно из ведущих мест в структуре заболеваний органов пищеварения. Отмечается рост частоты этой патологии, склонность к рецидивирующему течению, возможно развитие опасных для жизни осложнений. Важными представляются факты, свидетельствующие, что у 40-60% взрослых больных истоки заболевания находятся в детском возрасте.
Интерес научного мира к данному заболеванию обусловил проведение достаточного числа исследований в области его этиологии, патогенеза, клиники, диагностики, широко представленных в отечественных и зарубежных публикациях. В разные годы многие исследователи обращались к изучению роли кальция в патогенезе язвенной болезни, отмечая его роль в механизмах кислото- и пепсинообразования, клеточной пролиферации. Отмечалось участие в этиопатогенетических механизмах формирования язвенной болезни двенадцатиперстной кишки у детей кальцийрегулирующих гормонов, тесно связанных с процессами минерализации костной системы. Некоторые исследователи выявляли у больных изменение содержания кальция в различных средах организма (кровь, слюна, желудочный сок) [Омарова О. А., 1980 г.; Шапкина О. А., 1994 г.; Ипатов Ю. П., Комарова Л. Г., 1997 г.]. Обращается внимание на возможное нарушение поступления в организм кальция, так как деструктивно-воспалительный процесс располагается в зоне его преимущественного всасывания – двенадцатиперстной кишке. Все эти особенности не могут не сказаться на состоянии основного депо кальция и фосфора в организме – костной ткани, тем более в детском и подростковом возрасте, когда отмечается интенсивный рост скелета и потребности в данных биоэлементах наиболее значимы.
Наши исследования заключались в изучении остеометрических особенностей ЯБДК у детей в зависимости от клинического течения заболевания. Обследовано 211 детей в возрасте от 10 до 17 лет. Полученные результаты сравнивали с данными практически здоровых детей. Исследования проводились с учетом пола, возраста, длительности заболевания, частоты рецидивов и тяжести течения язвенной болезни.
Всем пациентам с ЯБДК и детям контрольной группы проведено обследование костной системы на компьютерном остеоденситометре DТХ-100 (Дания) методом количественной рентгеновской абсорбциометрии в периферических отделах лучевой и локтевой кости.
Изучение минерального содержания и минеральной плотности костной ткани у детей с язвенной болезнью двенадцатиперстной кишки выявило пониженные абсолютные и относительные показатели минерального содержания и минеральной плотности кости у пациентов с язвенной болезнью по сравнению со здоровыми сверстниками.
Изучение минерального содержания и минеральной плотности кости в зависимости от возраста определило снижение показателей у пациентов с ЯБДК во все исследуемые возрастные периоды по сравнению с контрольной группой. Достоверно ниже были результаты детей 12-16 лет, что объясняется высокой скоростью роста скелета в этом возрасте. Максимальное снижение минерального содержания и минеральной костной плотности выявлено у девочек 12-15 лет и у мальчиков 13-16 лет. Это обстоятельство мы связываем с различными возрастными темпами ускорения роста (у девочек 11-14 лет, у мальчиков 13-16 лет).
При изучении особенностей минерализации костной ткани в зависимости от пола было установлено, что общая частота остеопений у мальчиков и девочек встречалась примерно на одном уровне: 46,97% у мальчиков, 47,62% у девочек. Однако степень тяжести остеопений у них была различной. Нами выявлена большая предрасположенность мальчиков к развитию тяжелых остеопений II и III степени. Полученные результаты мы объясняем более слабым положительным влиянием андрогенов на процессы минерализации кости, чем эстрогенов.
Изучение минерального содержания и минеральной плотности кости в зависимости от длительности заболевания ЯБДК выявило снижение как абсолютных, так и относительных показателей минерального содержания и минеральной плотности кости в группах с более длительным сроком болезни. Меньшие результаты соответствовали пациентам с длительностью заболевания 3-5 лет. Однако у детей даже с небольшим сроком язвенной болезни (до 1 года) показатели минерального содержания и минеральной плотности кости были ниже, чем у здоровых сверстников.
Полученные в процессе исследования данные подтвердили имеющиеся литературные сведения о том, что поступление кальция из желудочно-кишечного тракта является главной детерминантой баланса этого биоэлемента в организме [Рожинская Л. Я., 1996, 1998 гг.].
В процессе обследования детей с ЯБДК нами были определены дополнительные факторы риска развития остеопении у данного контингента больных. Это нарушение процессов вскармливания на первом году жизни и нерациональное питание в последующие годы, характерные для пациентов с язвенной болезнью. С одной стороны, они предрасполагают к формированию хронической гастродуоденальной патологии, с другой – к низкому накоплению кальция в депо (кости). В дальнейшем развитие язвенной болезни двенадцатиперстной кишки способствует ухудшению минерализации костей и прогрессированию остеопении. Однако близость результатов исследования пациентов с длительностью заболевания от 1 до 3 лет и 3-5 лет позволила нам предположить, что степень снижения минерализации зависит не только от длительности заболевания, но и тяжести течения ЯБДК.
Изучение зависимости минерального содержания и минеральной плотности костей от тяжести течения ЯБДК выявило, что как абсолютные, так и относительные значения минерального содержания и минеральной плотности кости напрямую зависят от тяжести болезни. У детей с более частыми обострениями язвенной болезни показатели были ниже, чем у здоровых детей и пациентов с благоприятным течением заболевания без обострений. Наиболее низкие результаты получены при обследовании больных детей с рецидивирующим течением ЯБДК.
Важно отметить, что даже дети, не имеющие обострений язвенной болезни в течение 3-5 лет, также отстают по показателям минерализации костной ткани от здоровых сверстников, хотя длительная ремиссия способствует уменьшению тяжести остеопении. Следовательно, не только количество обострений и длительность заболевания, но и, вероятнее всего, длительность сохраняющегося активного гастродуоденита после рубцевания язвы влияет на степень минерализации костной ткани.
На основании проведенных исследований можно предположить, что язвенная болезнь двенадцатиперстной кишки у детей является фактором риска развития остеопенического синдрома. Критическими возрастными периодами формирования остеопении у детей с ЯБДК является возраст 12-15 лет у девочек и 13-16 лет у мальчиков; нарушения минерализации костной ткани наиболее выражены у мальчиков. Имеется отчетливая зависимость минерального содержания и минеральной плотности кости от особенностей течения язвенной болезни двенадцатиперстной кишки. Большая тяжесть нарушений (развитие остеопении II-III степени) характерна для пациентов с длительным и часто рецидивирующим вариантом заболевания.
Таким образом, язвенная болезнь двенадцатиперстной кишки оказывает влияние на минерализацию костной ткани детей 10-17 лет, способствует развитию остеопении. Степень отрицательного воздействия зависит от клинических особенностей заболевания. Наиболее существенными из них являются длительное течение болезни с частыми обострениями, что позволяет согласиться с мнением ряда ученых о нарушении абсорбции кальция в двенадцатиперстной кишке у пациентов с патологическими изменениями в этой зоне и, в частности, с ЯБДК. Однако дети с язвенной болезнью уже в первый год заболевания имеют меньшие показатели минерального содержания и минеральной плотности костной ткани. Вероятно, это связано, с одной стороны, с быстротой развития остеопении у данного контингента. Этому способствует высокая потребность организма детей в кальции, обусловленная интенсивным ростом скелета. С другой стороны, к снижению накопления костного минерала приводят нарушения вскармливания на первом году жизни и неправильное питание в последующие возрастные периоды, характерные для больных ЯБДК.
Выше было отмечено, что даже дети с отсутствием обострений заболевания в течение 3-5 лет отстают от здоровых сверстников по степени минерализации (следовательно, и прочности) кости. В то же время длительная ремиссия язвенной болезни способствует повышению минерального содержания костной системы, что снижает тяжесть остеопении.
Полученные нами сведения позволяют сделать вывод, что основными мерами по предупреждению остеопений у детей с ЯБДК являются профилактика обострений основного заболевания, ликвидация в минимальные сроки активного воспалительного процесса в луковице двенадцатиперстной кишки.
Выявленная в ходе исследования высокая частота остеопений у детей с ЯБДК 10-17 лет обосновывает необходимость остеометрического обследования данного контингента с момента выявления заболевания с рекомендацией проведения в дальнейшем ежегодных контрольных осмотров. Повышенного внимания требуют дети 12-16 лет, особенно мальчики.
Метаболизм кальция в биологических жидкостях при язвенной болезни двенадцатиперстной кишки у детей с различной степенью минерализации костной ткани
При хронических заболеваниях двенадцатиперстной кишки у детей особый интерес вызывает изменение содержания макроэлементов, в частности, кальция в биологических жидкостях организма. Хорошо известно участие кальция в перекисном метаболизме, мембранном транспорте, процессах воспаления и регенерации клеток слизистой, определяющих в свою очередь во многом характер течения гастродуоденальных заболеваний, в том числе язвенной болезни [Омарова В. А., 1980 г.].
Всасывание, секреция и реабсорбция кальция в желудке и кишечнике являются важными компонентами гомеостаза их в организме. Преимущественно через пищеварительный канал осуществляется также экскреция кальция. Всасывание кальция осуществляется в проксимальном отделе тонкой кишки, преимущественно в двенадцатиперстной кишке.
Воспалительные, дистрофические и атрофические изменения со стороны желудка и двенадцатиперстной кишки при патологии неизбежно сопровождаются нарушением всасывания кальция и фосфора.
Доказано участие кальция в патогенетических механизмах язвенной болезни двенадцатиперстной кишки. В настоящее время есть данные о том, что кальций в париетальных клетках слизистой оболочки желудка играет ключевую роль в регуляции их функциональной активности. Ионы кальция проявляют выраженное стимулирующее действие в отношении секреции пепсина, ускоряя его выход из клеток [Устянский Е. А., 1981 г.].
В желудочно-кишечном тракте постоянно взаимодействуют два процесса: всасывание кальция и его экскреция с пищеварительными соками. Исследования в этой области особенно актуальны в свете профилактики остеопений и остеопороза, так как именно в детском возрасте формируются основы минерализации костной ткани.
Мы изучали содержание кальция в пищеварительных соках при ЯБДК у детей в зависимости от степени минерализации костной ткани.
Исследования проводились в фазе обострения ЯБДК, максимально отражающей влияние заболевания на минеральный обмен ребенка. Всего обследовано 83 ребенка в возрасте от 10 до 16 лет. В основную группу наблюдения вошли дети (65 чел.) в фазе обострения ЯБДК, у которых по результатам денситометрии выявились как нормальная минерализация костной ткани, так и различные степени остеопении. Контрольную группу составили здоровые дети с нормальной минерализацией костной ткани (18 чел.).
Определение кальция проводилось всем детям в сыворотке крови, слюнном секрете, желудочном соке и I порции дуоденального зондирования. Подготовка материала исследования производилась по общепринятой методике. Содержание кальция определялось фотометрическим способом с использованием стандартных наборов «Lachema» (Чехия).
У всех детей (больных язвенной болезнью и у здоровых детей) определено содержание общего кальция в сыворотке крови. Данные показатели были в норме: в пределах от 2,25 ± 0,03 ммоль/л до 2,32 ± 0,01 ммоль/л. Также был оценен коэффициент распределения кальция (отношение кальция сыворотки крови к концентрации кальция в слюнном секрете). У детей с нормальной минерализацией костной ткани на фоне ЯБДК данный коэффициент составил 1,43; с I степенью остеопении – 1,49; со II-III степенью остеопении – 1,44; у здоровых детей – 1,60. Эту особенность можно объяснить снижением активности гематосаливарного барьера при повышении его проницаемости в фазу обострения ЯБДК. При этом в подгруппах детей с различной степенью минерализации костной ткани значения коэффициентов распределения кальция близки между собой, следовательно, не могут служить диагностическими критериями остеопении у данного контингента больных.
Исследование кальция в слюнном секрете показало, что у больных в фазе обострения ЯБДК в слюне повышена его концентрация.
Для выполнения поставленных задач изучались также базальная и стимулированная порции желудочного сока, определялась концентрация кальция.
В фазе обострения ЯБДК у всех детей отмечена гиперацидность. Выявлено также, что уровень кальция в базальной порции (вне зависимости от степени остеопении) выше, чем показатели здоровых детей. Однако содержание кальция у пациентов с нормальной минерализацией кости при ЯБДК (1,61 ± 0,09 ммоль/л) и остеопенией I степени (1,59 ± 0,03 ммоль/л) незначительно отличается от контрольных (1,56 ± 0,03 ммоль/л). В то же время у детей с остеопенией II-III степени на фоне ЯБДК этот показатель достоверно выше, чем в контрольной группе (1,74 ± 0,05 ммоль/л).
Исследования проводились также и в стимулированной порции желудочного зондирования. Результаты получены аналогичные показателям базальной секреции, т.е. более высокий уровень содержания кальция выявлен вновь у детей с остеопенией II-III степени – 1,71 СО ± 0,05 ммоль/л.
Учитывая повышение желудочной секреции и содержания кальция в желудочном соке в фазу обострения ЯБДК, особенно у детей с выраженными остеопениями, мы продолжили исследования по изучению концентрации кальция в зоне язвенного дефекта, двенадцатиперстной кишке – в зоне основного всасывания кальция.
Проведен анализ содержания кальция в I порции дуоденального зондирования, содержащей смесь нескольких секретов: сока двенадцатиперстной кишки, желчи и панкреатического сока. Исследования проводили в тех же подгруппах наблюдения.
Полученные данные свидетельствуют о высокой концентрации кальция и в двенадцатиперстной кишке у всех детей с ЯБДК в фазе обострения. Выявлено статистически достоверное различие результатов основной и контрольной групп (p<0,001). Более высокие значения кальция соответствуют детям с различными остеопениями. Результаты в этих подгруппах наблюдения достоверно отличаются не только от показателей контроля, но и от данных детей с нормальной минерализацией кости на фоне ЯБДК (p<0,001).
Необходимо учитывать тот факт, что повышение концентрации кальция в I порции дуоденального зондирования может быть обусловлено высокой кислотностью в двенадцатиперстной кишке. Этому в некоторых случаях способствуют возможные примеси желудочного сока в исследуемых порциях. Кроме того, появление очагов «желудочной метаплазии» в луковице двенадцатиперстной кишки приводят к повышению кислотности в дуоденальной зоне.
Повышение концентрации кальция в пищеварительных соках во время обострения заболевания, вероятно, ведет и к повышению потери данного биоэлемента через желудочно-кишечный тракт у детей с язвенной болезнью двенадцатиперстной кишки.
Язвенная болезнь двенадцатиперстной кишки в фазу обострения характеризуется усиленной экскрецией кальция во все пищеварительные соки (секрет слюнных желез, желудочный и дуоденальный сок), что является следствием нарушений в кальцийрегулирующей системе и ведет к потере кальция через кишечник, развитию остеопенического синдрома. Наиболее выражены потери кальция с пищеварительными соками у больных с остеопениями, особенно II–III степени тяжести. Остеопенический синдром у больных с язвенной болезнью двенадцатиперстной кишки, вероятно, можно рассматривать и как следствие нарушений механизмов кислотообразования при данной патологии.
Таким образом, многолетние наблюдения и разносторонние исследования в этой области показывают значительную роль патологии желудочно-кишечного тракта в формировании остеопороза. К сожалению, патогенетическое лечение остеопороза на фоне желудочно-кишечных заболеваний освящено в печати недостаточно. Большинство авторов указывают на существенные ограничения (например, трудности перорального пути) в лечении этой патологии. Особое внимание должно быть уделено лечению и профилактике основного заболевания, симптоматическому лечению остеопороза (здоровый образ жизни, диетотерапия, дозированные физические нагрузки, физиотерапевтические методы, ортопедические коррекции, что рассмотрено в других разделах монографии).
В периоды роста кости важно соблюдение следующих условий:
- полноценное питание с достаточным потреблением продуктов, содержащих кальций;
- исключение вредных привычек (курение, кофе, алкоголь);
- физическая активность;
- назначение витамина D и препаратов кальция;
- употребление молочных продуктов.
Целью лечения остеопороза при заболеваниях желудочно-кишечного такта являются:
- Замедление или прекращение потери костной массы.
- Предотвращение развития переломов костей.
- Снижение степени выраженности болевого синдрома.
- Улучшение общего состояния больного.
- Расширение двигательной активности.
- Максимально возможное восстановление трудоспособности и улучшение качества жизни.
Основными фармакологическими вариантами традиционного лечения остеопороза являются:
- Гормональная заместительная терапия.
- СМРЭ (селективные модуляторы эстрогеновых рецепторов).
- Кальцитонин.
- Паратироидный гормон.
- Бисфосфонаты.
- Комбинированная терапия.
Однако при заболеваниях желудочно-кишечного тракта, особенно в детском возрасте, возможности применения медикаментозных средств весьма ограничены, а иногда и противопоказаны. Из всех вышеназванных препаратов детям с заболеваниями желудочно-кишечного тракта, сопряженными с остеопорозом, возможно применение только бисфосфонатов, но с ограничениями. Основными побочными воздействиями бисфосфонатов на органы желудочно-кишечного тракта являются:
- эзофагит, изжога, дисфагия;
- образование язв желудка и двенадцатиперстной кишки.
Следовательно, при гиперацидных состояниях назначение бисфосфонатов не оправдано. Поэтому еще раз обращаем внимание на важность проведения профилактических мер по предотвращению развития остеопороза на фоне заболеваний желудочно-кишечного тракта, а это прежде всего своевременная диагностика и качественное полноценное лечение основного заболевания.
4.5. Остеопороз при ювенильном ревматоидном артрите
М. Н. Гербель
В последнее десятилетие во всех странах мира отмечен значительный рост заболеваемости опорно-двигательного аппарата у детей. Особая роль принадлежит ювенильному ревматоидному артриту (ЮРА), который занимает одно из ведущих мест в структуре неинфекционных заболеваний с хронизацией процесса, прогрессирующим характером течения, приводящим к ранней инвалидизации больных. Снижение качества жизни больных также обусловливает большую медико-социальную значимость этой патологии (Алексеева Е. И., 2000 г., Лукьянова Е. М. , 2002 г.).
Диагностика ЮРА сопряжена с определенными трудностями в связи с атипичностью суставного синдрома, пестротой клинических симптомов, недостаточностью диагностических критериев и большой вариабельностью течения заболевания. Установлено, что ювенильный ревматоидный артрит у детей негативно влияет на метаболизм костной ткани, особенно в период интенсивного роста, и является причиной развития вторичного остеопороза. Последний в свою очередь ухудшает прогноз ювенильного ревматоидного артрита, качество жизни больных и увеличивает риск переломов костей (Лила А. М., 2000 г., Марусенко И. М., 2003 г.). Немаловажную роль играет и противоревматическая терапия ЮРА, особенно длительное лечение глкокортикоидами и иммуносупрессорами, что способствует прогрессирующему снижению минеральной плотности кости (МПК) у данной категории больных (Bone mass in).
Факторы риска вторичного остеопороза при ЮРА
- Системные проявления (или осложнения) заболеваний:
- активация клеточного иммунитета;
- воспаление;
- снижение физической активности;
- гормональные нарушения.
- Осложнение терапии:
- глюкокортикоиды;
- метотрексат;
- циклоспорин А;
- прямые антикоагулянты.
Остеопороз при ревматоидном артрите рассматривается как своеобразный показатель «тяжести» заболевания и активности воспаления, а также как одна из причин низкой толерантности кости к травматическому воздействию (Рожинская Л. Я., 2000 г., Насонов Е. Л., 2001 г., Беневоленская Л. И., 2004 г.). Минеральные потери имеют характер «скрытой эпидемии», долгое время не проявляются клинически, с чем и связано недостаточное освещение данной проблемы.
При воспалительных заболеваниях суставов (ревматоидный артрит) прогрессирование деструкции суставов и костной резорбции находятся в тесной патогенетической взаимосвязи, поскольку в основе этих процессов лежат нарушения в системе иммунитета (Hofbauer L. C., Heufelder A. E.,2001, Horowitz M. C., Xi Y., Wilson K., 2001).
Таким образом, изучение нарушений метаболизма костной ткани может способствовать расшифровке фундаментальных механизмов иммунопатогенеза ревматических заболеваний и на этой основе разработке новых методов профилактики и лечения.
Патогенетические механизмы костной резорбции и остеопороза при ревматических заболеваниях
Основу воспаления составляет каскад биохимических и иммунологических процессов, регуляция которых осуществляется очень большим числом гуморальных медиаторов (Насонов Е. Л., Скрипникова И. А., 1997 г.; Насонов Е. Л., Самсонов М. Ю.,2001 г.). Среди них особое место занимают цитокины – небольшие белковые молекулы, обеспечивающие межклеточные коммуникации в процессе иммунного ответа и воспаления. Особенности нарушений иммунного ответа при различных заболеваниях человека во многом определяются активацией субпопуляций Т-лимфоцитов (главным образом СD4+ клеток), способных синтезировать цитокины различных типов. Условно выделяют 2 субпопуляции Т-лимфоцитов, которые обозначаются как Th1- и Th2-клетки. К цитокинам Th1 типа относят интерлейкин (ИЛ)-2, ИЛ-12, интерферон (ИФН) -γ, ИЛ-17, фактор некроза опухоли (ФНО)-α. К цитокинам Th2 типа – ИЛ-4, ИЛ-5, ИЛ-8, ИЛ-10, ИЛ-13. Цитокины Th1 типа принимают участие в реакциях клеточного иммунитета и определяются как «провоспалительные». Цитокины Th2 типа обеспечивают вспомогательный («хелперный») сигнал для синтеза антител (или аутоантител) и при определенных условиях тормозят синтез «провоспалительных» цитокинов, проявляя, таким образом, антивоспалительную активность (рис. 16, 17)
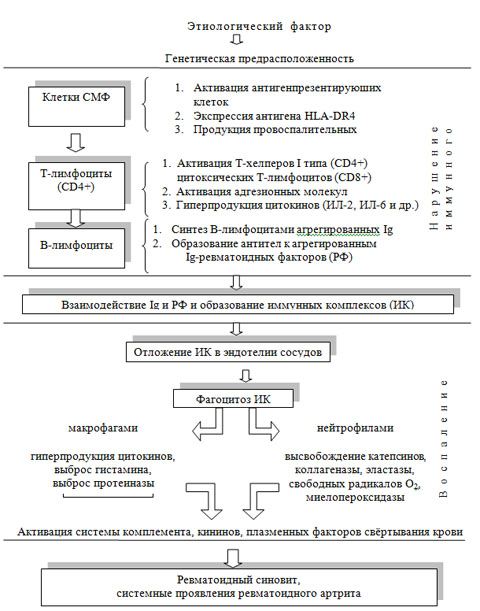
Рис. 16. Схема патогенеза ювенильного ревматоидного артрита (Мазуров В. И., 2000 г.)
В норме Т-лимфоциты не играют существенной роли в регуляции костного обмена. Однако «патологическая» активация Т-лимфоцитов, для которой характерно нарушение баланса между продукцией «провоспалительных» и «антивоспалительных» цитокинов (Корнилов Н. В., Аврунин А. С., 2000 г.), может индуцировать нарушение обмена костной ткани. Это связано с тем, что провоспалительные цитокины обладают способностью стимулировать, а антивоспалительные – тормозить резорбцию костной ткани (рис. 16-17 и табл. 11).
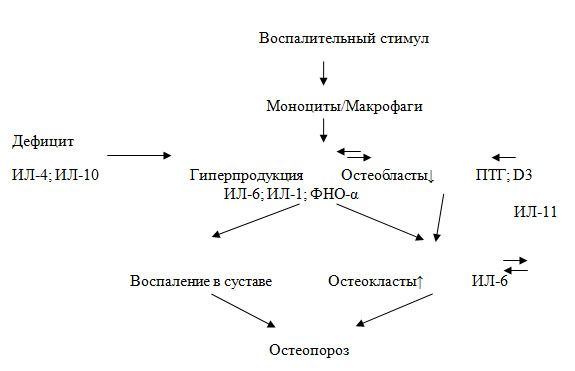
Рис. 17 Схема взаимосвязи между остеопорозом и воспалением
Таблица 11
Медиаторы воспаления и остеопороза при РА
| Медиаторы | Влияние на воспаление | Влияние на костную резорбцию | ||
| Стимуляция | Подавление | Стимуляция | Подавление | |
| ИЛ-1 | + | + | ||
| ФНО-α | + | + | ||
| ИЛ-6 | + | + | ||
| ИЛ-8 | + | + | ||
| ГМ-КСФ | + | + | ||
| ИЛ- 11 | + | |||
| ИЛ- 17 | – | + | ||
| Онкостатин М | + | + | ||
| ИЛ-4 | + | + | ||
| ИФН-γ | + | + | ||
| ИЛ-10 | + | + | ||
| ИЛ-13 | + | + | ||
| Антагонисты рецептора ИЛ-1 | + | + | ||
| Растворимый рецептор фактора некроза опухоли | + | + | ||
В развитии остеопороза при ювенильном ревматоидном артрите играют роль различные факторы риска (табл. 12)
Таблица 12
Основные факторы риска остеопороза при ЮРА
| Не связанные с болезнью | Связанные с болезнью |
| – Возраст – Женский пол – Низкая масса тела – Генетическая предрасположенность – Низкое потребление кальция и фосфора |
– Активность воспаления – Снижение физической активности – Лекарственная терапия (глюкокортикоиды, циклоспорин А, метотрексат) |
У детей, страдающих ювенильным ревматоидным артритом (ЮРА) выделяют два типа остеопороза:
- Периартикулярный (юкстаартикулярный), затрагивающий участки кости около пораженных суставов и расцениваемый как один из ранних диагностических критериев этого заболевания. Околосуставной остеопороз обычно диагностируется на ранней стадии болезни. Он обусловлен микроциркуляторными расстройствами, возникающими в связи с воспалением и начинающейся структурной перестройкой костной ткани. Степень его выраженности коррелирует с уровнем провоспалительных цитокинов.
- Генерализованный, характеризующийся системным снижением МПК и угрожаемый по риску переломов кости. У детей, страдающих ЮРА, выявлено существенное уменьшение МПКТ во всех участках скелета, но главным образом в кортикальных костях.
Оба типа остеопороза ассоциируют с длительностью заболевания, активностью воспалительного процесса, тяжестью функциональных нарушений, особенностями проводимой терапии и в разных участках скелета развиваются неравномерно, что отражает разнообразие их патогенеза у детей, страдающих ЮРА. Предполагается, что максимально интенсивное снижение МПК происходит в первые годы болезни, причем в это время пол не имеет значения, так как остеопороз одинаково часто диагностируется и у мальчиков, и у девочек. Анализ причин, способствующих развитию остеопороза у детей с ЮРА, позволяет считать, что нарушение физической активности ребенка играет в этом не последнюю роль, так как выявлена отрицательная связь между степенью инвалидизации и уровнем снижения МПК. Установлена также прямая связь между активностью воспалительного процесса и степенью выраженности остеопороза. Есть данные о том, что снижение МПК коррелирует с рядом показателей, свидетельствующих о быстропрогрессирующем течении ЮРА: персистирующим увеличением СОЭ, высоким уровнем СРБ, наличием ревматоидного фактора (РФ).
В настоящее время показано, что уровень СРБ – наиболее чувствительный и специфичный лабораторный параметр активности ЮРА. Напомним, что СРБ является классическим острофазовым белком, синтезирующимся в организме человека в ответ на воспаление и тканевое повреждение. В норме в сыворотке СРБ присутствует в следовых количествах (0,2-0,8 мг%), однако на фоне воспаления его концентрация может увеличиваться в 100-1000 раз. Повышение концентрации СРБ наблюдается уже через 4-6 ч. после повреждения ткани, а максимальная концентрация – через 24-72 ч. Синтез СРБ происходит в печени и регулируется провоспалительными цитокинами, в первую очередь ИЛ-6. Повышение уровня СРБ при РА связано только с активацией его синтеза. ИЛ-6 является маркером воспалительного процесса ревматоидного артрита у детей и одним из медиаторов, участвующим в нарушении ремоделирования костной ткани. При ЮРА наблюдается корреляция между концентрацией СРБ и уровнем ИЛ-6 в синовиальной жидкости и в сыворотке.
Таким образом, уровень СРБ адекватно отражает активность системного иммуновоспалительного процесса при ювенильном ревматоидном артрите.
Рентгенологические изменения в кистях коррелируют с тяжестью и скоростью прогрессирования патологического процесса при ревматоидном артрите. По литературным данным, у больных РА уровень СРБ коррелирует с наличием эрозий в суставах, прогрессированием эрозивного процесса.
Приведенные выше данные свидетельствуют о том, что скорость потери МПК у пациентов, страдающих ювенильным ревматоидным артритом, является индикатором системного катаболического процесса, отражающего активность воспаления, исследование которого в динамике может иметь важное клиническое и прогностическое значение.
Нами проведена оценка минерализации костной ткани у детей, страдающих ювенильным ревматоидным артритом в зависимости от клинического варианта и проводимой терапии.
Под наблюдением находились 130 детей в возрасте от 10 до 17 лет, которые были выделены в три группы: I группа – 75 больных ювенильным ревматоидным артритом (ЮРА) – составили основной контингент; II группа – 30 – с реактивным артритом (РеА); III группа – 25 условно здоровых детей (контрольная группа).
Цель исследования. Разработать новые подходы к ранней диагностике и лечению детей с ювенильным ревматоидным артритом на основании исследования минерализации костной ткани в различных участках костей предплечья.
Для диагностики остеопенического синдрома проводилось денситометрическое обследование рентгенабсорбционным методом в различных участках костей предплечья (ультрадистальном, дистальном, 1/4 дистальном). Показатели минерального содержания и минеральной плотности кости представлялись в виде абсолютных и относительных величин. Расчет производился в автоматическом режиме.
Для профилактики и лечения остеопенического синдрома детям с ЮРА назначались остеопротекторы: субстрат витамина D3 (аквадетрим) и активный его метаболит – оксидевит (25,OH-холекальциферол).
Изучая минерализацию костной ткани в различных участках костей предплечья (ультрадистальный, дистальный и 1/4 дистальный) у детей трех групп (I – ЮРА, II – РеА и III – контрольная), выявили, что при ювенильном ревматоидном артрите показатели минерального содержания (BMC) и минеральной плотности (BMD) костной ткани были самыми низкими во всех исследуемых участках костей предплечья по сравнению с детьми III (контрольная) и II (реактивный артрит) групп (табл. 13 и 14).
Наибольшее снижение минерализации костной ткани статистически достоверно (p<0,001) отмечалось в ультрадистальной части кости у детей с ЮРА как в абсолютных, так и в относительных величинах. Это свидетельствовало о повышенной резорбции костной ткани в этой части. Кроме этого, было отмечено достоверное падение минерального содержания и минеральной плотности костной ткани в 1/4 дистальном отделе костей предплечья у больных ЮРА. У детей с реактивным артритом снижение показателей минерализации костной ткани статистически достоверно происходило только в ультрадистальной части костей предплечья (p<0,05), а в 1/4 дистальной части падение данных показателей было недостоверным (p>0,05). Это можно объяснить тем, что кости предплечья в различных участках имеют разное строение с уменьшением кортикальной кости с 90% в 1/4 дистальном отделе до 35% в ультрадистальной части костей предплечья. Данное обстоятельство свидетельствует о том, что наиболее существенным для диагностики является снижение минерализации костной ткани в тех участках кости, где имеется наибольший удельный вес кортикального слоя.
Таблица 13
Показатели BMC в различных участках костей предплечий
| BMC (г) |
Статистический показатель | Группы наблюдений | ||
| ЮРА (I группа) n=75 |
РеА (II группа) n=30 |
КГ (III группа) n=25 |
||
| Ult | M±m | 0,770±0,03 | 1,946±0,01 | 2,275±0,05 |
| Dis | M±m | 1,757±0,04 | 2,417±0,02 | 3,092±0,07 |
| 1/4 dis | M±m | 2,382±0,03 | 3,387±0,08 | 3,474±0,02 |
| Достоверность различия, (p) | Ult | Dis | ¼ dis | |
| ЮРА – КГ | p<0,001 | p<0,001 | P<0,001 | |
| ЮРА – РеА | p<0,001 | p<0,001 | P<0,001 | |
| РеА – КГ | p>0,05 | p>0,05 | p>0,05 | |
Примечание: n – число детей
Таблица 14
Показатели BMD в различных участках костей предплечья
| BMD (г/см2) |
Статистич. показатель |
Группы наблюдений | ||
| ЮРА (I группа) n=75 |
РеА (II группа) N=30 |
КГ (III группа) N=25 |
||
| Ult | M±m | 0,266±0,004 | 0,321±0,004 | 0,357±0,002 |
| Dis | M±m | 0,299±0,004 | 0,408±0,008 | 0,427±0,005 |
| 1/4 dis | M±m | 0,512±0,006 | 0,544±0,003 | 0,590±0,005 |
| Достоверность различия, (p) | Dis | Ult | 1/4 dis | |
| ЮРА – КГ | p<0,001 | p<0,001 | p<0,001 | |
| ЮРА – РеА | p<0,01 | p<0,001 | p<0,001 | |
| РеА – КГ | p>0,05 | p<0,05 | p>0,05 | |
Выявленные изменения минерализации костной ткани у детей с ЮРА показали, что воспалительные изменения в суставах при данном заболевании оказывают значительное влияние на минеральное содержание и минеральную плотность костной ткани. Это приводит к задержке формирования пика костной массы.
Таким образом, нами установлено, что резорбция кости у больных ЮРА преобладает над процессами формирования костной ткани. Длительная активность болезни, ограничение подвижности способствуют развитию остеопений и остеопороза. Разрежение костной ткани у детей с ЮРА затрагивает как губчатое, так и компактное вещество кости, что подтверждает системный (генерализованный) характер нарушений. Исследование минерального содержания костной ткани в различных участках костей предплечий выявило различные темпы резорбции костной ткани у детей с ЮРА. Наибольшее снижение минерализации костной ткани отмечено в ультрадистальной части костей предплечья. Снижение минерального содержания костной ткани в 1/4 дистальной части костей предплечья характерно для ювенильного ревматоидного артрита и практически не встречалось у детей с реактивным артритом. Полученные данные можно использовать в целях ранней диагностики ювенильного ревматоидного артрита, остеопенического синдрома и дифференциальной диагностики с реактивным артритом.
Изучая минерализацию костной ткани в зависимости от нозологической формы артрита, мы выявили, что пациентов с остеопеническим синдромом было больше в I группе (ЮРА) – 65 детей из 75 (87±2%), а во II группе (РеА) – 14 человек из 30 (47±9%). При этом частота остеопении I степени в исследуемых группах составляла 31±5% (23 чел.) в I группе и 33±9% (10 чел.) во II группе. Частота остеопении II степени в I группе была 27±5% (20 пациентов), во II группе – 13±6% (4 чел.). Остеопения III степени и остеопороз были выявлены только у больных I группы в 20±5% (15 чел.) и 9±3% (7 чел.) случаев соответственно (табл. 15).
Таким образом, остеопенический синдром у детей, страдающих ювенильным ревматоидным артритом (ЮРА), встречался в 2 раз чаще, чем у детей с реактивным артритом (РеА).
Таблица 15
Степени тяжести остеопений в зависимости от нозологических форм
| Степень остеопений |
ЮРА n=75 |
РеА N=30 |
||
| абс. | M±m % |
абс. | M±m % |
|
| Норма | 10 | 13±4 | 16 | 54±9 |
| I степень | 23 | 31±5 | 10 | 33±9 |
| II степень | 20 | 27±5 | 4 | 13±6 |
| III степень | 15 | 20±5 | – | |
| Остеопороз | 7 | 9±3 | – | |
Примечание: n – число детей
При этом остеопения тяжелой III степени и остеопороз были выявлены только у детей с ЮРА. Полученные данные объясняем тем, что дети, страдающие ЮРА, относятся к группе высокого риска по развитию остеопенического синдрома. Известно, что дифференциальная диагностика ЮРА и РеА является трудной задачей, особенно в дебюте заболевания. Поэтому полученные данные могут быть использованы в целях дифференциальной диагностики этих заболеваний.
Исследование минерализации костной ткани в зависимости от клинического варианта ювенильного ревматоидного артрита (табл. 16) показало, что при любой клинической форме ЮРА у детей был выявлен остеопенический синдром различной степени тяжести.
Таблица 16
Степени тяжести остеопений в зависимости от клинических форм ЮРА
| Степень остеопений |
Суставная форма ЮРА n=61 |
Системная форма ЮРА n=14 |
||
| абс. | M±m % |
абс. | M±m % |
|
| Норма | 10 | 16±5 | – | – |
| I степень | 21 | 34±6 | 2 | 14±10 |
| II степень | 17 | 28±6 | 3 | 21±11 |
| III степень | 10 | 16±5 | 5 | 36±13 |
| Остеопороз | 3 | 5±3 | 4 | 29±13 |
При этом частота остеопении I степени у детей с суставной формой ЮРА составила 34±6% (21 чел.), у пациентов с системным вариантом – 14±10% (2 чел.). Частота встречаемости остеопении II степени составила 28±6% (17 детей) – при суставной форме и 21±11% (3 ребенка) – при системной форме. Остеопения III степени была выявлена в 16±5% случаев (10 больных) – при суставной форме и 36±13% случаев (5 больных) – при системной форме ЮРА. Остеопороз отмечался в 5±3% случаев (3 чел.) при суставной форме и 29±13% (4 чел.) – при системной форме ЮРА. Анализ полученных данных выявил тяжелую степень остеопении и остеопороз как при суставной форме, так и при системной форме ЮРА. Это мы связываем с хроническим воспалительным процессом в суставах, длительной патогенетической терапией, с применением глюкокортикостероидов, длительным ограничением физической активности. Однако тяжесть остеопенического синдрома была более выраженной при системной форме ЮРА.
При изучении показателей минерального содержания костной ткани (BMC, %) в зависимости от возраста у детей с ювенильным ревматоидным артритом и реактивным артритом (рис. 2) отмечено, что эти показатели в I (ЮРА) и II (РеА) группах были ниже результатов III (контрольной) группы во всех возрастных периодах. Однако у детей с ЮРА было отмечено достоверное снижение минерализации кости с 14 до 17 лет (с 77,0±0,2% до 75,7±0,3%). У детей с реактивным артритом такого же возраста, как и в контрольной группе, выявлено повышение показателей минерального содержания костной ткани с 93,0±0,1% до 100,5±0,5%, а в контрольной группе – с 95,8±0,1% до 105,3±0,5%. Полученные данные объясняем влиянием активации половых гормонов в пубертатном периоде. У детей с ЮРА пубертатного возраста метаболические нарушения в костях не уменьшались, а доклинический остеопенический синдром прогрессировал. Данный возрастной период можно считать «критическим» для процессов минерализации.
Рис.18. Показатели минерального содержания костной ткани (BMC, %) в зависимости от возраста
Анализируя показатели минерального содержания костной ткани (BMC) у детей с ювенильным ревматоидным артритом в зависимости от длительности заболевания, выявили зависимость BMC от длительности заболевания. Наименьшие показатели минерального содержания кости были выявлены у детей с длительностью заболевания ЮРА более 3 лет, что связано с преобладанием процессов резорбции костной ткани над костеобразованием.
Исследуя минеральное содержание костной ткани (BMC, %) в зависимости от патогенетической терапии, отметили достоверное снижение показателей минерального содержания костной ткани у всех больных ЮРА в сравнении с контрольной группой. Так, минеральное содержание костной ткани у детей, получавших в комплексной терапии глюкокортикостероиды, составило 58,3±1,4%. У больных ЮРА, не получавших глюкокортикостероидную терапию, минеральное содержание костной ткани было достоверно выше (84,1±1,5% p<0,05). Это мы объясняем негативным влиянием длительного применения глюкокортикостероидов на костный метаболизм.
Таким образом, больные ювенильным ревматоидным артритом, получающие глюкокортикостероидную терапию, относятся к группе повышенного риска по остеопеническому синдрому. Это свидетельствует о том, что патогенетическая терапия ЮРА, особенно длительное применение глюкокортикостероидов оказывает негативное влияние на костный метаболизм и усугубляет течение остеопенического синдрома, ухудшает качество жизни больных.
Исследуя влияние витамина D3 (аквадетрим) и его активного метаболита – оксидевита – на минеральное содержание костной ткани (BMC, %) у детей с ювенильным ревматоидным артритом, через 6 месяцев после назначения остеопротекторов отметили повышение показателей BMC в подгруппах E2 с 79,2±1,4% до 81,1±1,5% и Е3 с 78,6±1,6% до 85,2±1,5% (табл. 17). Однако при назначении двух остеопротекторов (витамина D3 и оксидевита) у детей подгруппы E3 было отмечено значительное и достоверное повышение минерального содержания кости. Ранняя профилактика и лечение остеопений и остеопороза у детей с ювенильным ревматоидным артритом снижает риск развития и прогрессирования остеопенического синдрома. Это особенно важно для больных ЮРА, получающих глюкокортикостероидную терапию. Нами отмечено, что при назначении двух остеопротекторов (витамина D3 и оксидевита) выявлено значительное повышение минерализации кости, что связано с улучшением всасывания кальция через кишечник, уменьшением резорбции костной ткани.
Таблица 17
Показатели BMC по Z-шкале у детей с ЮРА в зависимости от лечения остеопротекторами
| Подгруппы наблюдения |
Статист. показатель |
BMC (%) Z-шкала | |
| До лечения | Через 6 мес. после леч. | ||
| E1 (без остеопротекторов) |
M±m n=23 |
80,1±1,5 | 79,6±1,3 |
| E2 (получ. вит. D3) |
M±m n=27 |
79,2±1,4 | 81,2±1,5 |
| E3 (получ. вит. D3 и оксидевит) |
M±m n=25 |
78,6±1,6 | 85,2±1,5* |
Примечание: n – число больных; *- различие в сравниваемых группах статистически достоверно (р<0,05)
При изучении влияния остеопротекторов (витамина D3 и оксидевита) на клинику суставного синдрома ювенильного ревматоидного артрита через 6 месяцев отметили уменьшение клинических проявлений суставного синдрома в подгруппах E2 (получали только витамин D3) и E3 (получали два препарата: витамин D3 и оксидевит). Однако более выраженный эффект в лечении остеопенического синдрома оказывает совместное использование этих препаратов.
Таким образом, значительная распространенность данной патологии требует новых подходов к терапии ювенильного ревматоидного артрита с остеопеническим синдромом и лекарственных средств, стимулирующих костеобразование и подавляющих костную резорбцию. Доказано, что раннее и длительное назначение остеопротекторов, особенно двух препаратов (витамина D3 и его активного метаболита – оксидевита), оказывает положительное влияние на клиническое течение ювенильного ревматоидного артрита, особенно у больных, получавших длительную глюкокортикостероидную терапию. Кроме того, данные остеопротекторы положительно влияют на минерализацию костной ткани у детей с ЮРА.
Таким образом, больным с ювенильным ревматоидным артритом с целью раннего выявления остеопенического синдрома и дифференциальной диагностики с реактивным артритом показано денситометрическое исследование различных участков костей предплечья.
При выявлении остеопений и остеопороза у детей, страдающих ювенильным ревматоидным артритом, необходимо исследование минерального содержания костной ткани в динамике два раза в год с вычетом темпов потери до стабилизации процесса.
Детям с ювенильным ревматоидным артритом, особенно с остеопеническим синдромом, показано сбалансированное питание с включением в рацион продуктов с высоким содержанием кальция и метаболитов витамина D, двигательная активность.
С целью профилактики остеопений и остеопороза больным ювенильным ревматоидным артритом с нормальной минерализацией костной ткани показано сочетанное назначение витамина D3 в дозе 500-1000 МЕ/сут. и оксидевита в дозе 0,5 мкг/сут.
При выявлении у детей с ювенильным ревматоидным артритом остеопенического синдрома, особенно остеопении III степени и остеопороза, необходимо включать в комплексную терапию два остеопротектора: витамин D3 (аквадетрим) в дозе 1500-2000 МЕ/сут. и его активный метаболит оксидевит в дозе 1 мкг/сут. с остеометрическим контролем в динамике заболевания.
4.6. Остеопороз в практике стоматолога
Л. Д. Романовская, Н. В. Еремина, Н. А. Вирясова
Роль остеопороза в развитии стоматологических заболеваний изучена недостаточно, а имеющиеся сведения в литературных источниках довольно противоречивы. Поэтому в задачу исследований нами было включено изучение влияния недостаточной или избыточной минеральной плотности костей на течение и прогноз наиболее актуальных заболеваниий в стоматологии. Это касалось изучения состояния минеральной плотности костной ткани при флюорозе и очень распространенном заболевании – болезней парадонта. В частности выяснения роли стероидной терапии бронхиальной астмы в развитии заболеваний парадонта. Известно, что остеопороз лицевого скелета может быть причиной атрофии альвеолярных отростков и прогрессированию пародонтита.
4.6.1. Минеральная плотность костной ткани при флюорозе
Н. В. Еремина, Л. Д. Романовская, Н. А. Вирясова
Флюороз – это системное заболевание человека, которое возникает при избыточном поступлении в организм фтора (более 0,1-0,15мг/кг массы тела в сутки), обусловленное региональными геохимическими особенностями внешней среды, клиническим индикатором которого является поражение зубов.
В отечественной и зарубежной литературе достаточно публикаций об этиологии, клинике, патогенезе и лечении флюороза зубов (Овруцкий Г. Д., 1962 г., Окунев В. И., 1987 г., Гнатюк П. Я., 1989 г., Васюкова О. М., 1997 г., Николишин А. К. 1997 г., Fejerskov 1990, Banting D. W.,1991), однако мало работ, отражающих взаимосвязь дентального и костного флюороза. Если диагноз флюороз зубов можно поставить после визуального стоматологического осмотра, то единственным доступным методом по выявлению костной патологии до недавнего времени была стандартная рентгенография, позволявшая диагностировать нарушения в костной ткани лишь при выраженных изменениях минерального вещества кости (более 30-40%) (Гюнтер Т., 1995 г., Деквейкер Я., 1995 г.).
Следует отметить, что все имеющиеся в литературе исследования, посвященные диагностике костной патологии развивающейся при избыточном поступлении в организм фтора (Гамиянц С. А., 1991 г., Разумов В. В., 1991 г., Жовтяк Е. М., 2000 г.), были получены при обследовании лиц, страдающих профессиональным флюорозом. Работы по изучению состояния костной ткани у детей и подростков с флюорозом зубов единичны (Жуматов У. Ж., 1996 г.).
Новым подходом к обоснованию выбора диагностики нарушений костного скелета при флюорозе является использование высокоточных рентгеноабсорбционных компьютерных технологий, позволяющих обследовать пациентов в кратчайшие сроки и с минимальной (на уровне естественного радиационного фона) лучевой нагрузкой.
Целью нашего исследования являлось изучение различных клинико-лабораторных аспектов поражения зубов и костной ткани детей школьного возраста при флюорозе, выявление их взаимосвязи и разработка на основе полученных данных практических рекомендаций по профилактике и лечению данной патологии.
Для достижения поставленной цели были определены следующие задачи:
- Изучить заболеваемость и степень тяжести поражения зубов флюорозом, распространённость и интенсивность кариозного поражения у детей школьного возраста, проживающих в очаге эндемического флюороза.
- Исследовать минеральное содержание костной ткани у детей с флюорозом.
- Изучить минеральную плотность костной системы у детей с флюорозом в зависимости от тяжести клинических проявлений данного заболевания, а также в зависимости от наличия или отсутствия при этом кариозного процесса.
Для решения поставленных задач нами было проведено клиническое и инструментальное стоматологическое обследование детей подросткового возраста (10-16 лет) согласно требованиям и картам эпидемиологического обследования населения, разработанных экспертами ВОЗ (1995 г.). Всего было осмотрено 469 подростков. Все осмотренные были выделены в две терапевтические группы и шесть подгрупп.
В первую группу – контрольную (КГ) вошли 252 условно здоровых подростка, проживающих в городе Пенза (школа №74), в районе с видимо благополучной экологической обстановкой, употребляющих питьевую воду с содержанием в ней фтора в количестве 0,7-1 мг/л. Возраст осмотренных колебался в диапазоне 10-16 лет.
Во вторую – терапевтическую группу (ТГ) были включены 217 школьников 10-16-летнего возраста, постоянно проживающих в очаге эндемического флюороза (Пензенская область, посёлок Монтажный, школа №45), где содержание фтора в водоисточнике значительно превышает предельно допустимую концентрацию и составляет 4,5-4,6 мг/л. В зависимости от тяжести клинических проявлений флюороза зубов (используя классификацию Dean Н. Т., 1942) данная группа подразделялась на подгруппы: А, Б, В, Г, Д и Е.
Подгруппа А состояла из 18 школьников с сомнительной формой флюороза. В подгруппу Б входили 40 подростков с очень слабой формой флюороза. Подгруппа В состояла из 40 детей, имеющих слабую форму флюороза. Подгруппа Г включала в себя 48 школьников со средней (умеренной) формой флюороза. В подгруппу Д вошли 53 подростка, имеющие тяжелую форму флюороза. В подгруппу Е были включены 18 детей, проживающих в данной местности, но не имеющих флюороза зубов.
Из-за отсутствия различий в клинических проявлениях дентального флюороза у мальчиков и девочек деление по половому признаку не проводилось.
По результатам остеометрического исследования все подростки были выделены в три группы: I, II, III. В группу I вошли 44 подростка с нормальными показателями минеральной плотности костной ткани, в группу II – 29 детей с остеопениями, в группу III – 21 ребенок с увеличенными показателями минеральной плотности костной ткани.
Исследование минерализации костной ткани проводилось на компьютерном рентгеновском денситометре DTX-100 (Дания) в дистальном и ультрадистальном отделах костей предплечья.
Показатели, определяющие минерализацию костной ткани, были представлены в виде абсолютных и относительных величин. Клинически значимым абсолютным показателем являлась минеральная плотность костной ткани, рассчитываемая на диаметр кости и выражаемая в граммах на квадратный сантиметр. Относительные показатели, представляемые в процентах и условных единицах, позволяли соотнести полученные в ходе данного исследования результаты к среднетеоретической норме для пациентов мужского и женского пола определенного возраста (Z-шкала), а также определить разницу между реальной костной массой и пиком костной массы у здоровых мужчин и женщин в возрасте около 40 лет (Т-шкала). Диагноз остеопений и остеопороза устанавливался по стандартным отклонениям (СО) от среднего уровня пика костной массы: норма – от +1 до -1 СО; остеопения I степени – от -1 до -1,5 СО; остеопения II степени – от -1,5 до -2 СО; остеопения III степени относилась нами к тяжелой остеопении, поскольку снижение минеральной плотности костной ткани менее -2-2,5 СО неизбежно переходит в остеопороз (Fleish,1989). Содержание минеральной плотности костной ткани выше +1 СО расценивалось нами как гиперминерализация.
Результаты исследования и их обсуждение
При изучении распространенности флюороза и кариеса зубов и интенсивности кариеса среди детей КГ флюороза зубов даже в слабых формах выявлено не было. Заболеваемость флюорозом в ТГ составила 91,7%, при этом доминируют средняя (24%) и тяжелая (27%) формы. Распространенность кариеса в КГ зафиксирована на отметке 83,7%, с индексом КПУ 3,01, в то время как распространенность кариеса в ТГ была несколько ниже и составила 64,9% с КПУ в 1,5. Наиболее часто поражение зубов кариесом отмечалось при умеренной и тяжелой формах флюороза.
Исследование минеральной плотности костной ткани, по данным остеометрии, выявило нормальное содержание минеральной фракции скелета у 65 школьников КГ (из 68 обследованных), что составляет 95,6%. Увеличения МПКТ не отмечено, снижение костной массы не ниже значения в -1,5 СО (остеопения I степени) зарегистрировано только у 3 детей (4,4%).
Среди детей ТГ нормальное состояние МПКТ зарегистрировано лишь у 67 школьников, что составляет 37,2% от общего числа обследованных. В то время как у большинства – 113 (62,8%) – имелись изменения МПКТ. При этом гиперминерализация скелета отмечена у 11,7% подростков, на долю же снижения костной массы приходится 51,1% (остеопения I степени тяжести – 48 (26,7%), II степени – 37 (20,6%), III степени – 7 (3,8%).
При соотнесении остеометрических показателей к возрастной норме минерализации костной ткани у детей ТГ (Z-шкала) (таблица 18) было выявлено снижение МПКТ, зависимое от тяжести флюороза. При очень слабой, слабой формах МПКТ составила 105,9±2,4%, при средней форме 91,0±1,6%, при тяжелом флюорозе 82,3±1,1%, у детей КГ – 99,1±1,9%.
Таблица 18
Минеральная плотность костной ткани (%) в зависимости от тяжести флюороза зубов
| Группы наблюдения |
Статистический показатель |
Показатели денситометрии, % | |
| Z-шкала | Т-шкала | ||
| Контрольная группа |
n M ± m |
68 99,1 ± 1,9 |
68 60,1 ± 1,6 |
| Очень слабая, слабая (подгруппа Б, В) |
n |
66 |
66 |
| Средняя (подгруппа Г) |
n M ± m |
59 91,0 ± 1,6 |
59 55,3 ± 1,0 |
| Тяжелая (подгруппа Д) |
n M ± m |
55 82,3 ± 1,1 |
55 52,7 ± 0,9 |
| P1-2 P1-3 P1-4 P2-3 P2-4 P3-4 |
< 0,05 < 0,05 < 0,05 < 0,01 < 0,001 < 0,01 |
< 0,05 < 0,05 < 0,05 < 0,05 < 0,01 < 0,05 |
|
P1-2 – различие при сравнении показателей слабых форм флюороза с КГ
P1-3 – различие при сравнении средней формы флюороза с КГ
P1-4 – различие при сравнении тяжелой формы флюороза с КГ
P2-3 – различие при сравнении показателей слабых и средней форм флюороза
P2-4 – различие при сравнении слабой и тяжелой форм флюороза
P3-4 – различие при сравнении средней и тяжелой форм флюороза
При соотнесении остеометрических показателей к возрастному пику минерализации (T-шкала) значения МПКТ также пропорционально убывали по мере нарастания тяжести дентального флюороза. Различие МПКТ при различных формах флюороза было статистически достоверно как по Z-шкале (p2-3<0,01; p2-4<0,001; p3-4<0,01), так и по T-шкале (p2-3<0,05; p2-4<0,01; p3-4<0,05). Достоверное различие показателей было также выявлено при сравнении МПКТ у детей с различными формами флюороза и КГ (Z-шкала – p1-2<0,05; p2-3<0,05; p1-4<0,05, Т-шкала – p1-2<0,05; p2-3<0,05; p1-4<0,05).
Изучение минеральной плотности костной ткани у больных с флюорозом и кариесом (таблица 19) показало, что при соотнесении показателей остеометрии к возрастной норме минерализации (Z-шкала) МПКТ при флюорозе составила 105,9±2,4%, что достоверно выше, чем при флюорозе ассоциированном с кариесом – 81,8±2,3% (p2-3<0,001). Сравнивая флюороз без кариеса с показателями, полученными в КГ (99,1±1,9%), мы также получили достоверное различие (p1-3<0,005). Достоверно было отличие, полученное при сравнении КГ с флюорозом ассоциированным с кариесом (р1-2<0,05).
Таблица 19
Показатели денситометрии при флюорозе и флюорозе ассоциированном с кариесом к возрастной норме минерализации (Z-шкала) и возрастному пику минерализации (Т-шкала) костной ткани
| Группы наблюдения |
Статистический показатель |
Показатели денситометрии, % | |
| Z- шкала | Т-шкала | ||
| Контроль | n M ± m |
68 99,1 ± 1,9 |
68 60,1 ±1,6 |
| Флюороз ассоциированный с кариесом |
n |
109 |
109 |
| Флюороз | n M ± m |
71 105,9 ± 2,4 |
71 67,4 ± 2,0 |
| P1-2 P2-3 P1-3 |
< 0,05 < 0,001 < 0,005 |
< 0,05 < 0,005 < 0,05 |
|
P1-2 – различие при сравнении флюороза ассоциированном с кариесом с КГ
P2-3 – различие при сравнении флюороза с флюорозом ассоциированном с кариесом
P1-3 – различие при сравнении флюороза с КГ
Показатели МПКТ в зависимости от возрастного пика минерализации костей (T-шкала) изменялись параллельно значениям Z-шкалы. Максимальное значение было отмечено у детей с флюорозом – 67,4±2,0%, минимальное при сочетании флюороза с кариесом – 55,5±1,7%. Статистически достоверные различия были выявлены при сравнении КГ с детьми, страдающими флюорозом без кариозного поражения (p<0,05), и при сравнении между собой флюороза и флюороза ассоциированного с кариесом (p<0,005).
Из выше изложенного следует, что при сочетании флюороза с кариозным поражением нарушения в минеральной фракции костного скелета наиболее прогрессивны в сторону уменьшения МПКТ и протекают на фоне выраженного остеопенического синдрома. Об этом не следует забывать во время проведения стоматологического осмотра в очаге эндемического флюороза, поскольку сочетание флюороза зубов с кариесом дает возможность предположить существование остеопении у таких детей, а наличие флюороза без кариеса может свидетельствовать о нормальной или увеличенной МПКТ. В то время как флюороз без кариеса сопровождается нормальным состоянием костной массы или ее увеличением, вплоть до гиперминерализации.
- В очаге эндемического флюороза при концентрации фтора в питьевой воде 4,5-4,6 мг/л заболеваемость флюорозом составила 91,7%, доминируют умеренная и тяжелая формы. При этом распространенность кариеса ниже, чем в контрольной группе.
- Изменения минеральной плотности костной ткани у детей эндемического очага флюороза выявлены в 62,8% случаев и носят диаметрально противоположный характер. У 51,1% обследованных отмечено уменьшение МПКТ, а 11,7% увеличение МПКТ.
- Минеральная плотность костной ткани зависит от степени тяжести дентального флюороза. При очень слабой, слабой формах отмечалось увеличение МПКТ, при тяжелой – уменьшение МПКТ.
- Снижение минеральной плотности костной ткани характерно для флюороза ассоциированного с кариозным процессом. Флюороз без кариеса характеризовался нормой или некоторым увеличением МПКТ. Данное обстоятельство может быть использовано в клинической практике, так как наличие остеопении, по данным остеометрии, является фактором риска развития кариеса.
4.6.2. Минеральная плотность костной ткани у больных бронхиальной астмой с заболеваниями пародонта
Н. А. Вирясова, Л. Д. Романовская, Н. В. Еремина
ПИ – пародонтальный индекс Рассела
ПТГ – паратиреоидный гормон
СPI – коммунальный пародонтальный индекс ВОЗ, 1995 г.
PMA – папиллярно-маргинально-альвеолярный индекс
Заболевания пародонта являются наиболее распространенными болезнями человечества. По данным доклада научной группы ВОЗ (1990 г.), в котором обобщены результаты обследования населения в возрасте от 15-44 лет 53 стран, распространенность заболеваний пародонта составила 55-99% (Канканян А. П., Леонтьев В. К., 1998 г.; Иванов В. С., 2006 г.).
Особенности течения, прогноз и тактика лечения заболеваний пародонта тесно связаны с параметрами гомеостаза организма и приемом некоторых лекарственных препаратов (Григорьян А. С., Фролова О. А., 2004 г.).
Известно, что глюкокортикоиды (ГК) улучшают состояние мягких тканей пародонта благодаря противовоспалительному действию, но в то же время приводят к остеопорозу альвеолярной кости и дегенерации тканей пародонта в результате нарушения синтеза коллагена (Иксанов М. К., 1981 г.; Беляков Ю. А., 1983 г.; Дмитриева Л. А. и соавт., 2006 г.; Сильвестрова А. С., 2006 г.; Lacatusu S., Ghiorghe A., 2004). Глюкокортикоиды широко используются в терапии бронхиальной астмы, но их применение сопряжено с негативным влиянием на костную ткань. Даже короткие, но частые курсы терапии системными глюкокортикоидами (СКГ) могут быть причиной остеопороза (Беневоленская Л. И., Лесняк О. М., 2005 г.; Braun J., Sieper J., 2001; Van Staa T. P., 2006).
Роль стероидного остеопороза в развитии заболеваний пародонта изучена недостаточно, а имеющиеся сведения довольно противоречивы. Осложнения остеопороза в костях лицевого скелета могут проявляться в виде значительной атрофии альвеолярных отростков и прогрессировании пародонтита (Хасанов Р. А. и соавт., 2002 г.; Воложин А. И. и соавт., 2005 г.; Ivanyi L., Wong W.K., 1992; N. von Wowern et al., 1992; Javorsky L., Masurova Z., 2004). Наряду с этим многие авторы отмечают медленно прогрессирующее течение заболеваний пародонта на фоне приема глюкокортикоидов (Дмитриева Л. А. и соавт., 2006 г.; Сильвестрова А. С., 2006 г.; Lacatusu S., Ghiorghe A., 2004). На наш взгляд, аспекты, касающиеся состояния пародонта при пониженной минеральной плотности костной ткани больных бронхиальной астмой с приемом глюкокортикоидов, нуждаются в дальнейшем изучении.
В настоящее время с целью длительного контроля бронхиальной астмы применяют ингаляционные формы глюкокортикоидов (ИГК), в том числе у тех больных, которые ранее получали ежедневную терапию системными глюкокортикоидами (Бернс П., Годфри С., 2003 г.; Barnes P. J. et al., 1998; Harmanci E. et al., 2001). Имеются единичные сведения о состоянии твердых тканей зубов, пародонта и нарушении минерализующей функции слюны у детей, больных бронхиальной астмой, принимающих ингаляционные глюкокортикоиды (Вольхина Н. В., Кисельникова А. П., 1999 г.; Tootla R. et al., 2004; Komerik N. et al., 2005). В доступной нам литературе мы не обнаружили сведений о минеральном составе слюны взрослых с бронхиальной астмой, принимающих системные и ингаляционные глюкокортикоиды.
Целью нашего исследования явилось изучение клинико-патогенетических особенностей заболеваний пародонта у больных бронхиальной астмой с различной степенью минерализации костной ткани для разработки эффективных методов лечения и профилактики у них заболеваний пародонта.
Задачи исследования:
- Изучить клинику и особенности течения заболеваний пародонта у больных бронхиальной астмой при различных вариантах патогенетической терапии.
- Выявить корреляционные связи между тяжестью заболеваний пародонта и минеральной плотностью костной ткани при бронхиальной астме.
- Исследовать биохимические показатели слюны, сыворотки крови и мочи, отражающие состояние фосфорно-кальциевого обмена у больных бронхиальной астмой.
- Разработать принципы диспансеризации и лечения патологии пародонта у больных бронхиальной астмой с учетом состояния минеральной плотности костной ткани.
Всего обследовано 191 человек: 108 больных тяжелой и среднетяжелой формой бронхиальной астмой, 83 условно здоровых лиц группы сравнения. Все больные бронхиальной астмой соответствовали следующим критериям: возраст 35-55 лет, длительность заболевания бронхиальной астмой тяжелого или среднетяжелого течения не менее двух лет, длительность терапии системными глюкокортикоидами постоянно или прерывистыми курсами не менее двух лет, длительность терапии ингаляционными глюкокортикоидами не менее двух лет.
Сопутствующие заболевания и состояния, влияющие на плотность костной ткани, являлись критериями для исключения из обследования. К ним относили: гипертиреоз, гиперпаратиреоз, язвенную болезнь желудка, менопаузу более 5 лет, курение, прием препаратов для нормализации минеральной плотности костной ткани. В исследование также не брали больных с полной адентией, сахарным диабетом, приемом антибиотиков на момент обследования, почечной и печеночной недостаточностью, наличием хронических сопутствующих заболеваний в стадии обострения.
Больные бронхиальной астмой были распределены на три группы в зависимости от проводимой патогенетической терапии.
Первая (I) группа состояла из 41 больного бронхиальной астмой с ежедневным приемом системных ГК на протяжении от 2 до 11 лет, в среднем, 6,46±0,42 лет (кортикоидзависимая БА). Тяжелое течение БА было у 18 (43,90%) человек и среднетяжелое у 23 (56,10%) пациентов. В состав группы вошли 22 (53,65%) женщины и 19 (46,34%) мужчин. Возраст пациентов в группе был от 35 до 55 лет, в среднем составил 46,51±0,88 лет. 31 человек (75,61%) получал “Преднизолон” по ежедневной схеме приема в средней поддерживающей дозировке 9,76±0,67 мг/сут.; 10 больных (24,39%) принимали “Триамсинолон” (“Полькортолон”) в дозе 10,80±1,57 мг/сут. 19 человек (46,34%) сочетали прием системных глюкокортикоидов с приемом ингаляционных ГК в среднетерапевтических дозах.
Вторую (II) группу составили 35 человек с бронхиальной астмой. У всех больных наблюдалось среднетяжелое течение БА. Больные группы получали системные ГК для купирования приступа прерывистыми курсами с постепенной полной отменой препарата на протяжении от двух недель до месяца три-четыре раза в год. Женщин в данной группе было 18 (51,43%), мужчин -17 (48,57%). Возраст пациентов – от 36 до 55 года, в среднем 45,57±1,09 лет. Длительность приема ГК составляла от 2 до 20 лет, в среднем, 7,14±0,66 лет. 28 (80%) человек принимали преднизолон с начальной дозы, в среднем, 16,79±0,59 мг/сут; 7 (20%) человек получали триамсинолон с начальной дозировки, в среднем, 18,29±0,81 мг/сут. Все больные совмещали прием системных ГК с ингаляционными ГК в среднетерапевтических дозах.
В третью (III) группу были включены 32 больных бронхиальной астмой среднетяжелого течения. Пациенты третьей группы получали ингаляционные ГК на протяжении от 2 до 13 лет, средняя продолжительность лечения составила 5,67±0,51 лет. Группа состояла из 18 (56,25%) женщин и 14 (43,75%) мужчин. Возраст пациентов в данной группе – от 35 до 53 лет, в среднем – 45,56±1,13 год. 27 (84,38%) человек применяли препараты бекламетазона дипропионата в среднесуточной дозировке 375,92±27,78 мкг и 5 (15,63%) больных – “Будесонид” в среднесуточной дозе 460,00±50,99 мкг.
Группу сравнения (ГС) составили 83 практически здоровых человека, из них 39 мужчин (46,99%) и 44 женщины (53,01%). Возраст лиц КГ был от 35 до 55 лет, в среднем 45,36±0,80.
Группы были сопоставимы по возрасту и полу.
Полученные нами данные регистрировали в карте для оценки стоматологического статуса, разработанной экспертами ВОЗ (1995 г.), и в специальном дополнении к ней. Для изучения санитарной культуры и обращаемости к врачу-стоматологу проведено анкетирование больных бронхиальной астмой. Особое внимание уделялось анамнезу жизни и заболевания бронхиальной астмой, сведения о медикаментозной терапии, перенесенных и сопутствующих заболеваниях. Фиксировали жалобы, признаки экзогенного гиперкортицизма. При осмотре полости рта учитывали наличие мягких и твердых зубных отложений, кровоточивость десен, подвижность зубов, глубину пародонтальных карманов, патологическую стираемость, обнажение шеек и корней зубов, клиновидные дефекты, повышенную чувствительность зубов, патологию прикуса, некачественные зубные протезы и другие травмирующие факторы, состояние слизистой оболочки полости рта.
У всех обследуемых проводилась оценка гигиенического состояния полости рта с помощью индекса Грина-Вермиллиона OHI-S. Распространенность воспаления десны оценивали с помощью папиллярно-маргинально-альвеолярного индекса (РМА) Parma С. (1960). Определяли пародонтальный индекс Рассела ПИ и коммунальный пародонтальный индекс CPI (ВОЗ, 1995 г.), потерю эпителиального прикрепления десны. Кровоточивость десен оценивали с помощью зондовой пробы Мюлеманна (Muhlemann, 1971).
Для выявления характера и степени патологического процесса в костной ткани челюстей и альвеолярных отростков применяли метод ортопантомографии и внутриротовой рентгенографии отдельных зубов. Степень атрофии альвеолярного отростка по отношению к общей длине корня зуба регистрировали по данным рентгенологического индекса Fush (1946).
Обследование минеральной плотности костной ткани костей предплечья проводилось с помощью метода моноэнергетической рентгеновской абсорбциометрии на компьютерном денситиметре DTX-100 фирмы “Osteometr” (Дания).
Диагноз остеопении и остеопороза устанавливался согласно рекомендациям ВОЗ по Т-критерию. Уровень общего кальция и неорганического фосфора сыворотки крови и слюны, суточная экскреция кальция с мочой определялись фотометрическим способом по методикам F. Ulmand (1960) в модификации З. Словак (1974 г.). Активность щелочной фосфатазы сыворотки крови и слюны определяли по гидролизу β-глицерофосфата (метод Богдановского) с использованием реактивов фирмы «Lohcema» (Чехия).
Результаты исследований и их обсуждение
Изучение стоматологического статуса у больных бронхиальной астмой выявило низкий уровень санации полости рта. 89,81% больных БА нуждались в оказании стоматологической помощи (снятие зубного камня, лечение кариеса зубов и его осложнений). Большая часть пациентов БА (85,19%) нуждалась в протезировании в связи с частичным отсутствием зубов или некачественными зубными протезами.
У всех больных БА с приемом системных глюкокортикоидов имелись заболевания пародонта. У лиц группы сравнения частота заболеваний пародонта составила 91,57%. Обращает на себя внимание увеличение частоты генерализованных заболеваний пародонта у больных бронхиальной астмой. В группе сравнения хронический генерализованный пародонтит выявлен у 24,10% лиц. Хронический генерализованный пародонтит встречался у 68,29% больных первой группы, 62,89% – во второй и 37,50% больных третьей группы. В группах больных, принимающих системные глюкокортикоиды, имелся пародонтоз, которого не было среди лиц группы сравнения и больных, принимающих ингаляционные глюкокортикоиды. Частота пародонтоза в первой группе составила 14,64%, во второй – 5,71%.
У больных, применяющих ИГК, особенностей течения пародонтита не выявлено. Как показали наши исследования, течение хронического генерализованного пародонтита больных БА с ежедневным приемом системных глюкокортикоидов отличается ограниченным воспалением десны по данным индекса РМА, сниженной кровоточивостью десен, меньшей глубиной пародонтальных карманов. Для пародонтита больных БА, принимающих ГК по прерывистой схеме, характерна меньшая кровоточивость десен по сравнению с пародонтитом лиц ГС (таблица №20).
Таблица 20
Показатели, характеризующие состояние пародонта в подгруппах пациентов с хроническим генерализованным пародонтитом
| Подгруппы | РМА%, (Parma C.)M±m, р |
Потеря прикреп-ления, M±m, р |
Глубина карманов, мм, M±m, р |
Кровото-чивость десен, M±m, р |
X-ray Index,M±m, р |
| Iр (n=28) |
42,71±3,77* <0,05 |
0,92±0,15* <0,05 |
2,34±0,23* <0,05 |
1,76±0,07* <0,001 |
0,62±0,03* <0,01 |
| IIр (n=22) |
49,50±3,60 >0,05 |
0,53±0,16 >0,05 |
2,79±0,28 >0,05 |
1,89±0,05* <0,001 |
0,65±0,02* <0,05 |
| IIIр (n=12) |
57,63±8,15 >0,05 |
0,45±0,26 >0,05 |
3,46±0,39 >0,05 |
2,49±0,12 >0,05 |
0,66±0,05 >0,05 |
| ГСр (n=20) |
58,49±4,87 | 0,31±0,21 | 3,05±0,18 | 2,38±0,11 | 0,71±0,02 |
*-различие показателей больных БА и лиц подгруппы сравнения статистически значимо
Исследование минеральной плотности костной ткани показало, что пероральный прием глюкокортикоидов у больных БА приводит к остеопении или остеопорозу. В группе больных, ежедневно применяющих глюкокортикоиды, абсолютные и относительные показатели денситометрии были максимально снижены. В первой группе МПКТ в процентах от возрастной нормы больных БА составила 79,34±1,88 % (р<0,001), во второй-83,88±2,28 % (р<0,001), в третьей – 95,40±1,52% (р>0,05), у лиц группы сравнения – 98,95±1,51%. Показатели МПКТ относительно возрастного пика минерализации у больных БА также убывали от третьей к первой группе: самый низкий показатель МПКТ был в первой группе и составил 77,65±1,97% (р<0,001) от возрастной пика, во второй – 81,68±2,34% (р<0,001), в третьей – 93,71±1,48% (р>0,05), у лиц группы сравнения- 97,13±1,63%. Таким образом, применение ингаляционных глюкокортикоидов не вызывало статистически значимых изменений минеральной плотности костной ткани.
Анализ фосфорно-кальциевого обмена у больных БА выявил ряд особенностей. При изучении содержания общего кальция в смешанной слюне наблюдалось достоверное снижение данного показателя у больных первой (0,84±0,08 ммоль/л, р<0,001) и второй групп (0,95±0,06 ммоль/л, р<0,01) по сравнению с группой сравнения (1,24±0,06 ммоль/л). В третьей группе уровень кальция слюны (1,09±0,06 ммоль/л, р>0,05) статистически значимо не отличался от показателя ГС. При сравнении показателей первой и третьей групп выявлено статистически значимое различие показателей (р<0,05).
Уровень неорганического фосфора в слюне был значительно выше в группе гормонозависимых больных (5,54±0,10 ммоль/л, р<0,001) по сравнению группой сравнения (3,17±0,15 ммоль/л). Во второй группе уровень неорганического фосфора составил 3,36±0,21 ммоль/л (р>0,05), а в третьей 2,86±0,21 ммоль/л (р>0,05). Сравнение показателей первой группы с третьей показало, что уровень неорганического фосфора в первой группе достоверно выше (р<0,05).
Активность щелочной фосфатазы (ЩФ) смешанной слюны повышена у гормонозависимых больных БА до 1,63±0,07 ЕD (р<0,05) против 1,42±0,05 ЕD в ГС. Показатели второй (1,51±0,09 ED, р>0,05) и третьей группы (1,45±0,09 ED, р>0,05) значительно не отличались от ГС.
При изучении уровня общего кальция и неорганического фосфора сыворотки крови не выявлено статистически значимых различий данных показателей у больных бронхиальной астмой по сравнению с группой сравнения. Активность щелочной фосфатазы сыворотки крови повышена у гормонозависимых больных БА до 4,92±0,25 ЕD (р<0,05) против 4,31±0,17 ЕD в ГС, что указывает на усиленную резорбцию костной ткани данной группы больных. Показатели второй (4,53±0,31 ED, р>0,05) и третьей группы (4,10±0,22 ED, р>0,05) значительно не отличались от ГС.
Изучение суточной экскреции кальция с мочой показало увеличение данного показателя у больных БА, принимающих системные глюкокортикоиды, до 2,23±0,07 ммоль/л в сут. (р<0,001) в первой группе и до 2,11±0,07 ммоль/л в сут. (р<0,01) во второй группе против 1,89±0,04 ммоль/л в сут. в ГС. В третьей группе показатель составил 1,91±0,06 ммоль/л в сут. (р>0,05), что не отличается от группы сравнения.
В первой группе прослеживалась прямая корреляционная связь уровня кальция в слюне с абсолютными значениями минеральной плотности костной ткани, коэффициент корреляции равнялся 0,43 (р<0,01). Активность щелочной фосфатазы и уровень неорганического фосфора в слюне имели обратную корреляционную связь с абсолютными показателями МПКТ костей предплечья (уровни регрессии составили соответственно r=-0,53, p<0,001 и r=-0,38, р<0,05). Выявлена обратная корреляционная связь уровня ЩФ крови с минеральной плотностью костной ткани (r=-0,36, р<0,05). Во второй группе уровень кальция слюны коррелировал с МПКТ (r=0,38, р<0,05).
Лечение патологии пародонта, кариеса зубов и его осложнений, которые вызывают сенсибилизацию организма, у больных бронхиальной астмой представляет особую актуальность. Все манипуляции проводились под местной инфильтрационной и проводниковой анестезией. Для обезболивания у больных бронхиальной астмой использовали препараты на основе мепивакаина (Scandonest 3% plain, Mepivastesin), которые не содержат адреналин и дисульфит натрия. Местное лечение заболеваний пародонта начинали с устранения местных травмирующих факторов: снятия зубных отложений, замены плохо изготовленных протезов, некачественных пломб. Над- и поддесневой зубной камень снимали при помощи ультразвука, после чего корни зубов тщательно полировали с орошением растворами антисептиков. Для защиты кровяного сгустка и снятия воспаления применяли лечебные повязки.
Больных обучали гигиеническим навыкам ухода за полостью рта. Проводили беседу о важности регулярного правильного ухода за полостью рта в достижении успеха проводимой терапии и предупреждении деструкции пародонта. 3 пациентам первой и 4 – второй группы после консервативной терапии был проведен кюретаж пародонтальных карманов. Сроки заживления послеоперационной раны были обычными и составили 14-16 дней. Важной составной частью лечения заболеваний пародонта являлось рациональное протезирование, шинирование подвижных зубов, избирательное пришлифовывание зубов.
Больные бронхиальной астмой каждой группы были распределены на 2 подгруппы таким образом, что подгруппы были сопоставимы по основным показателям (возрасту, полу, минеральной плотности костной ткани, состоянию пародонта).
Системную терапию, направленную на нормализацию костного метаболизма, назначали с учетом степени снижения минеральной плотности костной ткани препаратами «Альфадол-Са» (PANACEA BIOTEC Ltd., Индия) и «Кальций-Д3 Никомед» (NYCOMED PHARMA AS). Больным БА с остеопорозом и остеопенией III степени назначали «Альфадол-Са» по 1 капсуле 2 раза в день 3-месячными курсами три раза в год, больным с остеопенией II и I степени по 1 капсуле 2 раза в день 2-месячными курсами три раза в год. С профилактической целью назначали «Кальций-Д3 Никомед» по 1 таблетке 2 раза в день во время еды трехмесячными курсами три раза в год больным БА с нормальной минеральной плотностью костной ткани.
Больным, принимающим «Альфадол-Са», раз в месяц проводили контроль уровня общего кальция, щелочной фосфатазы сыворотки крови, кальция в суточной моче во избежание развития гиперкальциемии и гиперкальциурии. При нормализации уровня щелочной фосфатазы сыворотки крови дозу «Альфадол-Са» снижали до 1 капсулы в день, что позволяло избежать развития гиперкальциемии.
Всем больным рекомендовали рациональное питание. Больные бронхиальной астмой проходили регулярные осмотры для выявления активности процесса заболевания пародонта и проведения поддерживающей терапии. Пациентам делали чистку зубов, при необходимости назначали местную антибактериальную терапию. Больных бронхиальной астмой с остеопорозом и остеопенией III степени осматривали 1 раз в два месяца, с остеопенией II и I степени 1 раз в четыре месяца и больных бронхиальной астмой с нормальной минеральной плотностью костной ткани – 1 раз в шесть месяцев.
На фоне лечения препаратами «Альфадол-Са» и «Кальций-Д3 Никомед» у больных БА наблюдали положительную динамику минеральной плотности костной ткани. У больных с ежедневным приемом глюкокортикоидов МПКТ, выраженная в стандартных отклонениях (Т-шкала), статистически значимо изменилась с -1,95±0,24 СО до -1,29±0,16 СО (р<0,05) через год и -1,19±0,13 СО (р<0,05) через три года. В подгруппе больных БА с приемом системных глюкокортикоидов по прерывистой схеме минеральная плотность костной ткани также статистически значимо увеличилась, исходное значение МПКТ -1,83±0,17 СО через год составило -1,36±0,14 СО (р<0,05) и -1,23±0,14 СО (р<0,05) через три года. Через три года диспансерного наблюдения увеличилась минеральная плотность костной ткани у больных БА с приемом ингаляционных глюкокортикоидов. Минеральная плотность костной ткани, выраженная в стандартных отклонениях, через три года была -0,73±0,09 СО (р<0,05) при исходном уровне -1,01±0,10 СО.
Таким образом, курс лечения заболеваний пародонта с применением комбинированных препаратов, нормализующих фосфорно-кальциевый обмен, показал положительные результаты, что подтверждается данными клинического и лабораторного обследования. Об эффективности трехлетней диспансеризации свидетельствуют повышение минеральной плотности костной ткани, стабильные показатели индексов, характеризующих состояние гигиены, воспаления пародонта, деструктивных процессов в костной ткани альвеолярных отростков челюстей, нормализация минерального состава слюны больных бронхиальной астмой.
Лечение заболеваний пародонта у больных бронхиальной астмой, начатое в стационаре врачом-стоматологом, должно продолжаться на амбулаторном этапе. Согласованная работа врача-пульмонолога, врача-аллерголога и врача-стоматолога нам представляется целесообразной в плане профилактики, ранней диагностики и квалифицированного лечения заболеваний пародонта и патологии костной ткани у больных бронхиальной астмой с приемом системных глюкокортикоидов.
Заключение
- Хронический генерализованный пародонтит встречается у 68,29% больных бронхиальной астмой с постоянным приемом системных глюкокортикоидов, у 62,89% больных с приемом глюкокортикоидов для купирования приступа и у 37,50% больных, применяющих ингаляционные глюкокортикоиды. Среди больных бронхиальной астмой, применяющих системные глюкокортикоиды, выявлен пародонтоз у 14,64% с ежедневным приемом и 5,71% больных с приемом по прерывистой схеме.
- Длительный прием системных глюкокортикоидов негативно отражается на костной ткани и приводит к остеопении или остеопорозу. В группе больных, ежедневно применяющих системные глюкокортикоиды, выявлены максимально низкие абсолютные и относительные показатели периферической рентгеновской денситометрии. Установлена обратная корреляционная связь тяжести деструктивных изменений пародонта по данным индекса ПИ с минеральной плотностью костной ткани у больных бронхиальной астмой, применяющих системные глюкокортикоиды постоянно (r=-0,46, р<0,01) и прерывистыми курсами (r=-0,39, р<0,05).
- Прием системных глюкокортикоидов влияет на минеральный состав слюны. В группе больных бронхиальной астмой с постоянным приемом глюкокортикоидов снижение уровня общего кальция слюны сопровождается повышением уровня неорганического фосфора и активности щелочной фосфатазы слюны. С приемом системных глюкокортикоидов прерывистыми курсами уровень общего кальция слюны снижен, коррелировал с минеральной плотностью костной ткани (r=0,38, р<0,05).
- При длительном ежедневном приеме системных глюкокортикоидов увеличивается активность щелочной фосфатазы крови, что свидетельствует об усиленной резорбции костной ткани у больных бронхиальной астмой. Повышение экскреции кальция с мочой у пациентов, получающих пероральные глюкокортикоиды, отображает выраженную потерю кальция при данном виде терапии.
- Применение ингаляционных глюкокортикоидов значительно не влияет на состояние пародонта, костной ткани, биохимические показатели фосфорно-кальциевого обмена смешанной слюны и сыворотки крови у больных бронхиальной астмой.
- Разработанный в ходе исследований комплексный подход к лечению и профилактике заболеваний пародонта с применением препаратов «Альфадол-Са» и «Кальций-Д3 Никомед» оказывает благоприятный клинический эффект на ткани пародонта, а также позволяет нормализовать минеральную плотность костной ткани, уровень общего кальция, неорганического фосфора и активность щелочной фосфатазы слюны у больных бронхиальной астмой.
- Оценка минеральной плотности костной ткани, показателей фосфорно-кальциевого обмена больным бронхиальной астмой, получающим терапию глюкокортикоидами, необходима в системе контроля безопасности терапии стероидами и профилактике деструкции костной ткани пародонта.
- Применение препаратов для нормализации фосфорно-кальциевого обмена («Альфадол-Са», «Кальций-Д3 Никомед») у больных бронхиальной астмой позволяет повысить эффективность местного лечения заболеваний пародонта и способствует клинико-рентгенологической стабилизации патологического процесса в пародонте и костной ткани.
- Больные бронхиальной астмой нуждаются в диспансерном наблюдении у врача-стоматолога, кратность осмотров устанавливается индивидуально с учетом состояния минеральной плотности костной ткани и характера патологии пародонта.
- Актуальные проблемы остеопороза. Монография
- Актуальные проблемы остеопороза. Список сокращений
- Актуальные проблемы остеопороза. Монография В.И. Струкова. Введение
- Актуальные проблемы остеопороза. Часть I. Физиология костной ткани и патфизиология костных переломов. В. И. Струков
- Актуальные проблемы остеопороза. Часть II. Факторы риска остеопороза. В.И. Струков
- Актуальные проблемы остеопороза. Часть II. Факторы риска остеопороза. В.И. Струков
- Актуальные проблемы остеопороза. Часть III. Классификация остеопороза. Клинические варианты остеопороза, определение. В.И. Струков
- Актуальные проблемы остеопороза. Часть IV. Вторичный остеопороз
- Актуальные проблемы остеопороза. Часть V. Диагностика остеопороза
- Актуальные проблемы остеопороза. Часть VI. Остеопения и остеопороз у детей и подростков
- Актуальные проблемы остеопороза. Часть VII. Профилактика и лечение остеопороза
- Актуальные проблемы остеопороза. Заключение





