ООО «Издательство «СпецЛит».
«Клиническая ревматология: краткий курс».
Авторы: Всеволод Владимирович Скворцов,
Александр Владимирович Тумаренко
190 103, Санкт-Петербург, 10-я Красноармейская д.15.
тел/факс: (812) 495-36-09/12
Содержание
Профилактика заболеваний щитовидной железы, гипер- и гипотиреоза
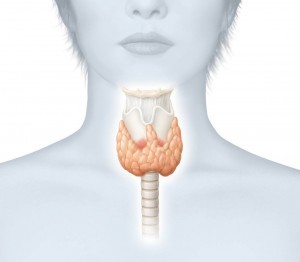
Впервые щитовидную железу описал знаменитый римский врач Гален в классическом тракте «О частях человеческого тела». Название, которым мы сейчас пользуемся, является переводом названия этого органа «гландула тиреоидея», (от греческого «гландула» — железа, «тиреос» — щит, «идея» — образ, вид). У человека щитовидная железа имеет форму галстука-бабочки. Она находится в области шеи и состоит из двух долей расположенных по обеим сторонам трахеи и соединена тонким перешейком на уровне II—IV колец дыхательного горла. Щитовидная железа заключена в капсулу и удерживается связками. Вес железы около 25—30 г. При этом она остается невидимой: ее невозможно увидеть и прощупать на шее. Такой размер называют 0 степень (по Николаеву).
Щитовидная железа состоит из множества фолликулов диаметром 0,1 мм, которые заполнены прозрачным «коллоидом», содержащим гликопротеин тиреоглобулин. Стенка каждого фолликула состоит из одного слоя кубических клеток. При активации аденогипофиза клетки фолликулов становятся цилиндрическими и на их внутренней поверхности появляются микроворсинки.
Патология щитовидной железы с повышенным или пониженным содержанием тиреоидных гормонов в крови (гипо- или гипертиреоз) относится к наиболее часто встречаемым заболеваниям эндокринной системы.
В 1915 г. английские ученые Б. Бауман и Р. Росс в ткани щитовидной железы обнаружили первый из вырабатываемых ею биологически активных веществ — тироксин (Т4) и расшифровали его формулу: четыре атома йода и незаменимая аминокислота тирозин.
В 1952 г. исследователям удалось выделить другой гормон — трийодтиронин (Т3). Его молекула содержит на один атом йода меньше, «усеченная» форма намного активнее полного варианта.
Т3 — главный тиреоидный гормон, непосредственно влияющий на обмен веществ. Лишь 3—5 % продукции щитовидной железы приходится на активный Т3, в то время как 95 % составляет более нейтральный в биологическом отношении Т4. Попадая в ткани, тироксин по мере необходимости теряет йод и постепенно включается в контроль над клеточным дыханием и другими процессами.
Остальные 2—5 % произведенных щитовидной железой веществ — это промежуточные соединения тирозина с йодом, не обладающие гормональной активностью: дийодтиронин (Т2) и монойодтиронин (Т1), которые в ходе биохимических преобразований превращаются в Т3 и Т4.
Гипертиреоз (тиреотоксикоз)
Гипертиреоз — это повышение функции щитовидной железы; синдром, обусловленный избытком тиреоидных гормонов в крови.
Наиболее частая причина гипертиреоза — зоб диффузный токсический (болезнь Грейвса-Базедова). Зоб узловой токсический (болезнь Пламмера) наблюдают реже, чем болезнь Грейвса-Базедова, и обычно у более пожилых лиц.Подострый тиреоидит (тиреоидит де Кервена) способен вызвать преходящий гипертиреоз. Следствием бесконтрольного приема тиреоидных гормонов может быть искусственный гипертиреоз.
Обычно диффузный токсический зоб встречается у женщин в возрасте от 30—60 лет, но могут болеть и лица обоего пола различного возраста.
Установлено, что в основе патогенеза диффузного токсического зоба лежит выработка антител к рецептору тиреотропного гормона (ТТГ), которые обусловливают стойкую гиперстимуляцию и пролиферацию тиреоцитов, рост фолликулярных клеток. Взаимодействие тиреоидстимулирующих антител с рецептором ТТГ приводит к увеличению синтеза и повышенному выбросу в кровь тиреоидных гормонов, что обуславливает картину гипертиреоза.
В развитии диффузного токсического зоба основную роль играют генетическая предрасположенность. В наследовании этого заболевания играют роль гены системы HLA, а также другие гены, расположенные вне локуса гистосовместимости, которые участвуют в наследовании аутоиммунных заболеваний щитовидной железы.
Установлено, что генетические особенности иммунного реагирования чаще проявляются при воздействии определенных психосоциальных и средовых факторов, таких как стресс, инфекции, курение, ионизирующая радиация.
В литературе, посвященной диффузному токсическому зобу, неоднократно подчеркивалась роль психической травмы, эмоционального стресса в развитии заболевания. Однако в настоящее время это предположение оспаривается. Более того, проведенные в различных странах эпидемиологические исследования не подтверждают того, что эмоциональный стресс может играть этиологическую роль в развитии диффузного токсического зоба.
И все же следует иметь в виду, что при стрессе повышается секреция гормонов мозгового вещества надпочечников (адреналин и норадреналин), которые, как известно, увеличивают скорость синтеза и секреции тиреоидных гормонов. С другой стороны, стресс активирует гипоталамо-гипофизарную систему, усиливает секрецию кортизола, ТТГ, что может служить триггером — пусковым моментом в механизме развития диффузного токсического зоба. По мнению большинства исследователей, эмоциональный стресс участвует в развитии данного заболевания путем влияния на иммунную систему организма.
Данные результаты исследований дают основание для проведения первичных профилактических мероприятий гипертиреоза, направленных на уменьшение или устранение воздействия на организм вышеперечисленных факторов.Безусловно, огромная роль в борьбе с курением, стрессом отводится не только медицинским работникам, психологам, но и СМИ, телевидению, печатным и интерактивным публикациям, популяризующим здоровый образ жизни. Также все более актуальной становится проблема антропогенного и техногенного загрязнения окружающей среды, в частности, радиационного загрязнения с изотопами йода, которая требует незамедлительных мероприятий по улучшению экологии планеты и отдельно взятой страны с привлечением правительственных структур, экологов и т. д.
Активное привлечение психологов к работе учебных заведений, государственных предприятий и частных компаний также должно включаться в программы первичной профилактики гипертиреоза с целью развития стрессоустойчвости и умения минимизировать роль стрессового фактора в повседневной жизни.
Вторичная профилактика гипертиреоза направлена на раннее выявление соответствующей симптоматики, что достигается скрининговым исследованием, прежде всего, в аспекте ежегодной диспансеризации населения и при более тщательном обследовании определенных групп населения (беременных, новорожденных и т. д.).
В случае раннего выявления симптоматики удается провести максимально эффективное и менее затратное лечение, а также предотвратить возможные осложнения.
Профилактика тиреотоксического криза:
- устранение провоцирующих факторов;
- полная компенсация функции щитовидной железы перед струмэктомией или радиойодтерапией мерказолилом и препаратами йода;
- назначение в предоперационном периоде гликокортикоидов, если больной принимал их в прошлом, недавно перенес инфекционное заболевание, но эутиреоидного состояния достичь не удалось, а также при наличии симптомов гипокортицизма (артериальная гипотензия);4. дробное применение радиоактивного йода: распределение суммарной дозы на 2—3 приема на фоне антитиреоидной терапии;
- назначение в предоперационном периоде (по показаниям) антигистаминных средств, сердечных гликозидов на фоне антитиреоидной терапии;
- тщательное врачебное наблюдение в послеоперационном периоде;
- ограничение оперативных вмешательств вне щитовидной железы до излечения больного от токсического зоба.
Гипотиреоз
Гипотиреоз — клинический синдром, вызванный длительным стойким недостатком гормонов щитовидной железы в организме или снижением их биологического эффекта на тканевом уровне. Распространенность манифестного (явного) первичного гипотиреоза в популяции составляет 0,2—1 %, латентного первичного гипотиреоза — 7—10 % среди женщин и 2—3 % среди мужчин. За 1 год около 5 % случаев латентного гипотиреоза переходит в манифестный.
Патогенетически гипотиреоз классифицируется на:
- первичный (тиреогенный),
- вторичный (гипофизарный),
- третичный (гипоталамический),
- тканевой (транспортный, периферический).
По степени тяжести первичный гипотиреоз подразделяют на:
- латентный — повышенный уровень ТТГ при нормальном Т4,
- манифестный (компенсированный, декомпенсированный) — гиперсекреция ТТГ, при сниженном уровне Т4; имеются клинические проявления,
- тяжелого течения (осложненный) — наблюдаются тяжелые осложнения, такие как кретинизм, сердечная недостаточность, выпот в серозные полости, вторичная аденома гипофиза.
В подавляющем большинстве случаев гипотиреоз является первичным. Наиболее часто он развивается в исходе аутоиммунного тиреоидита, реже — после резекции щитовидной железы и терапии радиоактивным йодом. Можно выделить врожденные и приобретенные формы первичного гипотиреоза.
Причиной врожденного гипотиреоза, встречающегося с частотой 1 случай на 4 000—5 000 новорожденных, являются аплазия и дисплазия щитовидной железы, эндемический зоб, врожденный дефицит ТТГ, синдром периферической резистентности к тиреоидным гормонам.
Основной причиной поражения большинства органов при гипотиреозе является резкое уменьшение выработки целого ряда клеточных ферментов вследствие дефицита тиреоидных гормонов. Нарушение обмена гликозаминогликанов приводит к инфильтрации слизистых, кожи и подкожной клетчатки, мышц, миокарда. Нарушение водно-солевого обмена усугубляется избытком вазопрессина и недостатком предсердного натрийуретического фактора.
Клинические проявления гипотиреоза разнообразны. Следует помнить о том, что необходим тщательный расспрос больных для выявления симптомов, связанных с гипотиреозом, т. к. обычно жалобы пациентов скудны и неспецифичны и тяжесть их состояния не соответствует субъективным ощущениям. Кроме того, при гипотиреозе поражаются практически все органы и системы, а современная структура медицинской помощи заставляет больных обращаться к специалистам узкого профиля.
Больных беспокоят постепенное увеличение массы тела (значительное ожирение нетипично), сухость и утолщение кожи, изменение ее цвета (наиболее часто употребляются термины «восковой», «персиковый» и «желтушный» цвет кожи), огрубение черт лица, увеличение размеров обуви, нечеткость речи. Периодически, особенно после нагрузок, могут появляться боли в правом подреберье, запоры, боли в грудной клетке, одышка при ходьбе.
Иододефицитные заболевания и гипотиреоз
В условиях йодного дефицита щитовидная железа подвержена воздействию комплекса стимулирующих факторов, которые обеспечивают продукцию адекватного количества тиреоидных гормонов в условиях дефицита основного субстрата для их синтеза. В результате у наиболее предрасположенных лиц происходит увеличение щитовидной железы — формируется диффузный эутиреоидный зоб (I этап). В зависимости от выраженности йодного дефицита, он может формироваться у 10—80 % населения.
Отдельные клетки щитовидной железы оказываются более чувствительными к указанным стимулирующим влияниям, благодаря чему получают преимущественный рост. Так формируется узловой и многоузловой эутиреоидный зоб (II этап).На III этапе описанные компенсаторные процессы начинают приобретать патологическое значение. В отдельных активно делящихся тироцитах начинают запаздывать репаративные процессы, в связи с чем накапливаются мутации, среди которых наибольшее значение приобретают так называемые активирующие, в результате чего дочерние клетки приобретают способность автономно, то есть вне регулирующих эффектов ТТГ, продуцировать тиреоидные гормоны.
Конечным этапом естественного морфогенеза йододефицитного зоба является узловой и многоузловой зоб (IV этап).
Многолетними исследованиями установлено, что на фоне внедрения массовой йодной профилактики заболеваемость в популяции постепенно снижается.
Йод является жизненно необходимым микроэлементом, основная масса его концентрируется в щитовидной железе, крови. Для нашей страны проблема йодного дефицита чрезвычайно актуальна, так как более 70 % густонаселенных территорий страны имеют недостаток йода в воде, почве и продуктах питания местного происхождения.
По данным эпидемиологических исследований, проведенных Эндокринологическим научным центром Российской Академии медицинских наук (РАМН), в Российской Федерации не существует территорий, где население не подвергалось бы риску развития йоддефицитных заболеваний. Фактическое потребление йода жителем России составляет 40—80 мкг / сут., что в 2—3 раза меньше рекомендуемой нормы. Распространенность эндемического зоба в России составляет 15—40 %, а в отдельных регионах — до 80 %.
Вопросы йодной профилактики нарушений функции щитовидной железы (профилактика йододефицитных заболеваний)
Профилактика и лечение йододефицитных заболеваний в России имеют общенациональное значение, что объясняет комплексный характер необходимых мероприятий. Решение этой задачи находится в прямой зависимости от методов и средств, при помощи которых органами и учреждениями здравоохранения проводится профилактика, лечение и мониторинг заболеваний, связанных с дефицитом йода. Данные методы и средства, учитывая всю важность и серьезность проблемы, должны соответствовать общепринятым международным стандартам.В настоящее время борьба с дефицитом йода координируется в глобальном масштабе Международным советом по контролю за йододефицитными заболеваниями — International Council for Control of Iodine Deficiency Disorders (ICCIDD), работающим в тесном контакте с ВОЗ. Для борьбы с дефицитом йода на популяционном уровне ВОЗ и ICCIDD рекомендуют использовать йодированную соль. В последние десятилетия эксперты ВОЗ за счет реализации национальных программ по массовой йодпрофилактике (в основном путем всеобщего йодирования пищевой поваренной соли) добились значительных успехов в ликвидации иододефицитных заболеваний.
Потребление йода оценивается ВОЗ как нормальное в 105 странах. Однако 30 % детей, страдающих от врожденного кретинизма в связи с нехваткой йода в мире до сих пор не получают достаточное количество йода.
Спектр йододефицитных заболеваний широк и, помимо патологии щитовидной железы, в него входит целый ряд гинекологических, акушерских и неврологических заболеваний. Причем наиболее тяжелые состояния, связанные с дефицитом йода, ассоциированы с внутриутробными нарушениями развития плода. К ним относятся: эндемический кретинизм, неонатальный зоб, гипотиреоз, различные врожденные аномалии.
Роль гормонов щитовидной железы во время беременности чрезвычайно велика. Тиреоидные гормоны оказывают влияние на синтез белка и рост клеток, стимулируют синтез РНК в ядре, активируют тканевое дыхание. Гормоны щитовидной железы имеют большое значение для развития плода, роста и дифференциации тканей, влияя на все виды обмена веществ. Усиливая процессы метаболизма, тиреоидные гормоны повышают потребность в различных ферментах и, соответственно, в необходимых для их синтеза витаминах. Нарушение функции щитовидной железы приводит к серьезным осложнениям беременности: выкидышам, мертворождению, аномалиям развития плода.
Тиреоидные гормоны необходимы для нормального функционирования практически всех органов и систем. Они ускоряют процессы синтеза трансферрина и усиливают абсорбцию железа в ЖКТ, активно стимулируют эритропоэз, синтез белка и нуклеиновых кислот в костном мозге. Нарушение обменных процессов в костном мозге становится причиной развития железодефицитной анемии и В12-фолиеводефицитной анемии.
Помимо этого, вне беременности тиреоидные гормоны оказывают стимулирующий эффект на дифференциацию гранулезных клеток, тормозят фолликулостимулирующую и повышают лютеинизирующую функцию гипофиза, стимулируют функцию желтого тела, увеличивают чувствительность яичников к гонадотропным гормонам, повышают чувствительность эндометрия к эстрогенам, способствуют становлению двухфазного менструального цикла, совместно с половыми стероидами стимулируют в пубертатный период завершение физической, половой и психической дифференцировки.
С началом беременности тиреоидные гормоны тормозят фолликулостимулирующую и повышают лютеинизирующую функцию гипофиза, тем самым стимулируя развитие желтого тела в яичнике, что важно для поддержания гестации на ранних сроках. Тиреоидные гормоны играют важную роль в развитии плода (рост плода, процессы оссификации, формирование ЦНС, созревание легочной и почечной ткани, становление системы иммунитета). При дефиците тиреоидных гормонов у плода наблюдается уменьшение массы головного мозга и содержания в нем ДНК, а также ряд гистологических изменений. Достаточный уровень циркулирующего Т4 является решающим для нормального функционирования и созревания нервных клеток и развития нейрональных связей.
Рост и развитие скелета (костной ткани), а также хрящей скелета находятся в прямой зависимости от снабжения организма ребенка йодом. Было доказано, что на уровне костей гормоны щитовидной железы стимулируют деление клеток, образующих костное вещество, а также ускоряют отложение в кости минералов (главным образом соли кальция и фосфора).
Как показывают исследования, развитие нервной системы и интеллекта ребенка также во многом зависят от гормонов щитовидной железы. Кроме того, формирование нервной ткани и головного мозга требует больших энергетических затрат. Установлено, что йодсодержащие гормоны щитовидной железы ускоряют обмен веществ и выработку энергии на уровне головного мозга, тем самым обеспечивая развивающийся орган энергетическими ресурсами и строительным материалом.
Заслуживает внимания тот факт, что организм плода или организм ребенка, находящегося на грудном вскармливании, полностью зависят от состояния здоровья матери. Поэтому роль правильного питания и достаточного поступления в ее организм различных витаминов и микроэлементов обеспечивает достаточный обмен веществ и энергии.Для самой беременной женщины или кормящей матери йод является не менее важным элементом, чем для ребенка или плода.
Связано это с тем, что, во-первых, нормальное развитие беременности требует значительного ускорения обмена веществ, которое возможно только при условии нормального функционирования щитовидной железы; во-вторых, развитие молочных желез и выработка молока также зависят от уровня снабжения организма матери йодом.В условиях йодного дефицита плацентарное разрушение тиреоидных гормонов приводит к развитию относительной гестационной гипотироксинемии, которая может неблагоприятно отразиться на развитии плода. Известно, что в первом триместре щитовидная железа плода только формируется, и его развитие будет осуществляться исключительно под действием тиреоидных гормонов матери, которые проникают через плаценту. Наличие как манифестного, так и субклинического гипотиреоза может иметь необратимые последствия для развития плода и функций его мозга.
Дефицит йода во время беременности и даже непосредственно перед ней приводит к хронической стимуляции щитовидной железы, относительной гипотироксинемии, формированию зоба как у матери, так и у плода, а также развитию более тяжелых йододефицитных заболеваний. Зоб, развившийся во время беременности, подвергается обратному развитию после родов лишь частично, а сама беременность может быть одним из факторов, действием которого объясняется большая распространенность заболеваний щитовидной железы у женщин по сравнению с мужчинами.
Процесс развития зоба у плода четко ассоциирован с низким уровнем потребления йода матерью во время беременности. При сравнении с помощью УЗИ объема щитовидной железы у новорожденных от матерей, получавших и не получавших профилактическую терапию препаратами содержащими калия йодид на протяжении беременности, в среднем объем щитовидной железы оказывается примерно на 40 % больше у 10 % новорожденных от матерей, не получавших профилактические дозы йода.
Основным методом профилактики йоддефицитных заболеваний согласно рекомендациям ведущих экспертов ВОЗ, ЮНИСЕФ, Международного совета по контролю за йододефицитными состояниями, а также многолетнему мировому опыту является всеобщее йодирование соли. Однако ввиду возрастания потребности в йоде на фоне беременности и лактации возникает необходимость в дополнительном назначении физиологических доз йода.
До тех пор, пока сохраняется природный йодный дефицит и не проводятся массовые профилактические мероприятия, среди беременных и кормящих должна проводиться индивидуальная и групповая профилактика фармакологическими препаратами, содержащими фиксированную дозу калия йодида.
Определение экскреции йода с мочой при популяционных исследованиях — важный компонент в системе контроля за эффективностью профилактических программ.
Необходимо отметить, что на практике компенсировать недостаток йода за счет различного рода диет практически невозможно. Большинство продуктов питания содержат слишком малые количества йода. Более того, при помощи диеты нельзя обеспечить равномерное поступление йода в организм. В связи с этим для профилактики йододефицита в современной медицине используются витаминно–минеральные средства. В настоящее время существует множество таких препаратов, разработанных специально для беременных женщин.Учитывая, что закладка нервной системы плода происходит на 3—4 неделе беременности (в это время женщина может даже еще не знать о факте наступления беременности), специалисты рекомендуют начинать профилактику йододефицита еще до момента наступления беременности, то есть в период планирования и подготовки к ней. В дальнейшем рекомендуется поддерживать нормальное поступление йода в организм женщины на протяжении всей беременности и в период кормления грудью.
Выбор конкретного препарата должен осуществляться в соответствии с рекомендациями врача-специалиста, наблюдающего беременную, или специалиста по планированию беременности. Важно отметить, что для профилактики йододефицита во время беременности гораздо лучше использовать препараты с дозированным содержанием йода, которые позволяют осуществлять точный контроль йода, поступающего в организм беременной. Кроме того, перед началом приема препаратов йода важно удостовериться, что функция щитовидной железы сохранена, также надо учитывать, что прием йодсодержащих препаратов противопоказан больным с гипертиреозом.
На сегодняшний день в Российской Федерации для беременных и кормящих женщин оптимально назначение фармакологических препаратов, содержащих калия йодид в дозировке 200—250 мкг / сут. на протяжении всего периода гестации и грудного вскармливания.
К таким препаратам относится йодбаланс, содержащий 100 или 200 мкг калия йодида.
Йодбаланс, являясь источником йода, восполняет его дефицит в организме, препятствует развитию йододефицитных заболеваний, предотвращает развитие зоба, связанного с недостатком йода в пище; нормализует размер щитовидной железы у новорожденных, детей и взрослых.
Показаниями к применению йодбаланса являются: профилактика и лечение йоддефицитных заболеваний, в том числе диффузного эутиреоидного зоба; профилактика рецидива зоба после его хирургического удаления, а также по завершении лечения зоба препаратами гормонов щитовидной железы. Противопоказания для назначения данного препарата: тиреотоксикоз, герпетиформный дерматит Дюринга; токсическая аденома, узловой токсический зоб (за исключением предоперационной терапии с целью блокады щитовидной железы); повышенная чувствительность к йоду.
Йодбаланс не следует принимать при гипотиреозе за исключением тех случаев, когда развитие последнего вызвано выраженным дефицитом йода. Назначения препарата следует избегать при терапии радиоактивным йодом, наличии рака щитовидной железы или при подозрении на него.Учитывая то, что препарат хорошо проникает через плаценту и может вызвать развитие гипотиреоза и зоба у плода, и что йод также выделяется с грудным молоком, применение препарата в период беременности и кормления грудью возможно только в рекомендуемых дозах.
При подготовке и планировании беременности, на протяжении всего периода гестации, а также при кормлении грудью йодбаланс назначают по 200 мкг / сут. (1 таблетка йодбаланса в дозировке 200 мкг или 2 таблетки йодбаланса по 100 мкг). Суточную дозу препарата следует принимать в один прием, после еды, запивая достаточным количеством жидкости. Профилактика дефицита йода и эндемического зоба с использованием калия йодида в суточной дозе 200 мкг способна без больших затрат в короткие сроки и без вреда для матери и плода значительно улучшить состояние здоровья беременной и практически свести на нет йододефицитные заболевания.
Явный гипотиреоз и тиреотоксикоз имеют многочисленные неблагоприятные последствия для здоровья. Наряду с этим субклинический гипотиреоз имеет тенденцию прогрессировать до манифестного, особенно у лиц с циркулирующими антителами к щитовидной железе. Кроме того, субклинический гипотиреоз может быть ассоциирован с гиперхолестеринемией, обратимой на фоне заместительной терапии, особенно в тех случаях, когда уровень ТТГ превышает 10 мМЕ / л. У части пациентов субклинический гипотиреоз сопровождается рядом обратимых симптомов, в том числе когнитивными нарушениями.
Определение уровня ТТГ является точным, широко доступным, надежным и относительно недорогим тестом для диагностики и профилактики любых вариантов нарушения функции щитовидной железы.
Ведущие российские и зарубежные эксперты выделяют среди населения особые группы суперкритического (беременные, кормящие женщины, дети первых 3 лет жизни) и критического (дети старше 3 лет, подростки, женщины репродуктивного возраста) риска развития иододефицитных заболеваний и гипотиреоза. Этим категориям населения в отсутствие законодательного регулирования массовой йодной профилактики в регионе проживания требуется проведение групповых профилактических мероприятий, предусматривающих постоянный прием препаратов калия йодида в дозировках, соответствующих официальным рекомендациям ВОЗ.
Для адекватного удовлетворения потребности организма в йоде рекомендуются следующие физиологические нормы ежедневного потребления этого эссенциального микроэлемента, предложенные ВОЗ /ICCIDD (2001, 2007): 90 мкг / сут. детям в возрасте 0—5 лет, 120 мкг / сут. школьникам 6—12 лет, 150 мкг / сут. подросткам и взрослым, 250 мкг / сут. беременным и кормящим женщинам.
Профилактика йоддефицитных заболеваний у новорожденных и детей грудного возраста
Для младенцев, находящихся на грудном вскармливании, данный вопрос решается путем коррекции питания самой матери. Большое значение придается регулярному приему в период лактации фармакологических препаратов йода.
Более серьезная проблема связана с коррекцией питания грудных детей, находящихся на искусственном вскармливании. Для детей, не получающих материнское молоко с рождения либо после 3—6 мес жизни, единственными продуктами детского питания, которые могут обеспечить их необходимым количеством йода, остаются обогащенные микроэлементом искусственные молочные смеси (заменители женского молока) и каши на их основе.
В соответствии с последними рекомендациями, утвержденными ВОЗ, содержание йода в смесях для доношенных детей должно составлять 100 мкг / л, а для недоношенных — 200 мкг / л. Таким образом, лишь около половины смесей по количеству йода соответствуют требованиям международных экспертных организаций.
При выборе смеси родителям необходимо ориентироваться на сбалансированность ее состава по всем основным ингредиентам (белки, жиры, углеводы, витамины и др.) Содержание йода обычно указывается на упаковке с заменителем грудного молока (в 100 г сухой смеси или в 100 мл готовой). Чтобы суточная доза вводимого со смесью йода соответствовала профилактической, его содержание в 100 мл готовой смеси должно составлять не менее 9—10 мкг, а в 100 г сухой — не менее 70 мкг.
Во втором полугодии жизни потребность в йоде несколько возрастает, а объем потребляемой смеси уменьшается. В связи с этим всем детям, находящимся на любых заменителях женского молока, во втором полугодии жизни необходимо дополнительное назначение йода в составе фармакологических таблетированных препаратов и / или продуктов прикорма (каши, натуральные продукты).
Если мать кормит ребенка грудью, а йодная профилактика по каким-либо причинам не проводится, ребенок с самого рождения нуждается в ежедневном приеме не менее 90 мкг йода.
При использовании заменителя молока с недостаточным содержанием йода (< 9 мкг в 100 мл готовой смеси) дополнительное введение йода в рацион ребенка проводится индивидуально, согласно рекомендациям специалистов.
Пути профилактики йоддефицита у детей от 1 года до 3 лет. Уровень содержания йода в поваренной соли при проведении массовых профилактических мероприятий соответствует потребностям взрослого человека, получающего 4—10 г поваренной соли в сутки. У детей, особенно до 3 лет, потребность в натрии ниже, а в йоде — чуть меньше, чем у взрослых: она составляет 90 мкг / сут. Поэтому количество йода, получаемого ребенком с йодированной поваренной солью, не может быть достаточным.
Для восполнения дефицита этого микроэлемента в данной возрастной группе наряду с продуктами, обогащенными йодом (каши) в обязательном порядке должны использоваться физиологические дозы йода в составе таблетированных препаратов йодида калия.
Пубертатный период. В период полового созревания функция щитовидной железы претерпевает определенные изменения, связанные с адаптацией к быстрому темпу роста и развития. В начале пубертатного периода происходит повышение уровня ТТГ с последующим повышением уровня Т4. Эти изменения являются физиологическими и направлены на поддержание высокого уровня обмена веществ. Рост объема щитовидной железы в этот период определяется не только влиянием ТТГ, но и усилением периферической конверсии Т4 в Т3, ускорением экскреции йода, увеличением синтеза тироксинсвязывающего глобулина. Кроме того, недостаточное поступление йода повышает чувствительность тиреоцитов к стимулирующему влиянию ТТГ.
В йоддефицитных регионах процесс полового созревания нередко сопровождается формированием диффузного эутиреоидного зоба. Среди всех групп населения эндемический зоб с наибольшей частотой встречается именно у подростков, особенно у девочек. Предпочтительным методом профилактики эндемического зоба у подростков можно считать назначение препаратов йодида калия или поливитаминов, содержащих физиологические дозы йода.
Меры вторичной профилактики гипотиреоза: своевременное выявления перехода аутоиммунного тиреоидита в гипотиреоидное состояние и назначение адекватной заместительной терапии (такие препараты, как левотироксин, тиреотом, тиреокомб, тиреоидин). Аутоиммунные процессы и формирование новообразований в щитовидной железе часто развиваются одновременно.
Женщины с высокими титрами антител к тиреопероксидазе во время беременности, но с нормальным уровнем ТТГ в сыворотке должны наблюдаться после родов в течение 6—8 мес. в связи с возможностью развития послеродового тиреоидита и клинического гипотиреоза (развивается у 5—7 % женщин). Если у них имеется сопутствующая аутоиммунная патология, например сахарный диабет I типа, то риск развития послеродового тиреоидита значительно возрастает.
Гипотиреоз при послеродовом тиреоидите часто бывает транзиторным, поэтому через 1 год тиреоидные препараты отменяют с последующим контролем уровня ТТГ не ранее чем через 3 мес. после отмены. Сохранение эутиреоза будет означать, что функция щитовидной железы восстановилась и заместительную терапию можно прекратить. Повышение уровня ТТГ будет свидетельствовать о стойком характере гипотиреоза и необходимости возобновления приема левотироксина, начиная с 25 мкг / сут с постепенным повышением до 100 мкг / сут.
Если у женщины с послеродовым тиреоидитом без каких–либо симптомов определяется повышение уровня ТТГ, но не выше 10 мЕд / л и она не планирует очередную беременность, назначение лечения не является обязательным, но необходим контроль уровня ТТГ через 4—8 недель. При повышенном ТТГ и планировании очередной беременности показана заместительная терапия малыми дозами тиреокомба.
Вопросы профилактики собственно гипотиреоза
Довольно высокая распространенность гипотиреоза, неспецифическая симптоматика, а также моно- или асимптоматическое течение среди наиболее многочисленной группы — пожилых больных, приводят к тому, что ряд крупных эндокринологических ассоциаций предлагают проведение скрининговых исследований функции щитовидной железы не только у новорожденных, но и у взрослых.
Наиболее частые причины возникновения основных форм гипотиреоза:
- аномалии развития щитовидной железы (дисгенез и эктопия),
- аутоиммунный тиреоидит,
- резекция щитовидной железы и тиреоидэктомия,
- подострый тиреоидит (гипотиреоидная фаза),
- тиреостатическая терапия (препараты радиоактивного и стабильного йода, лития, тиреостатики),
- врожденные энзимопатии, сопровождающиеся нарушением биосинтеза тиреоидных гормонов,
- гипофизарная недостаточность (синдром Шиена-Симондса, крупные опухоли гипофиза, аденомэктомия, облучение гипофиза),
- изолированный дефицит ТТГ,
- нарушение синтеза и секреции тиролиберина.
Учитывая многообразие причин гипотиреоза, принципы профилактики этих состояний могут быть различными. Врожденный гипотиреоз — наиболее частая патология щитовидной железы у детей. Частота встречаемости врожденного гипотиреоза составляет 1 случай на 3 500—4 000 новорожденных. Достижения в области молекулярной генетики позволили выявить мутации различных генов, приводящих к развитию заболевания.
Чем раньше возникает гипотиреоз у детей, тем выше риск необратимого повреждения мозга, поэтому выявлять врожденный гипотиреоз необходимо в ранний постнатальный период, чтобы не допустить задержки психомоторного и физического развития детей. Ранняя диагностика стала возможной благодаря внедрению государственной системы неонатального скрининга на врожденный гипотиреоз.
Скрининг позволяет поставить диагноз в первые недели жизни ребенка и избежать тяжелых и необратимых последствий. Оптимальным временем забора крови при скрининге считается 3—5 день жизни, когда происходит снижение уровня ТТГ, который в неонатальном периоде значительно выше, чем у более взрослых детей. При установлении диагноза и в сомнительных случаях терапия эутироксом назначается незамедлительно.
Развитие вторичного гипотиреоза может быть связано с патологией гипофиза вследствие разрушения опухолью, оперативным вмешательством, облучением или нарушением кровообращения либо с патологией гипоталамо-гипофизарной области.
Вторичный гипотиреоз редко бывает изолированным. Как правило, он сопровождается дефицитом других тропных гормонов гипофиза, в частности адренокортикотропного и фолликулостимулирующего гормонов, пролактина и соответствующими клиническими проявлениями. Диагностика вторичного гипотиреоза основана на определении пониженного уровня свободного тироксина (Т4). Уровень ТТГ при вторичном гипотиреозе может быть пониженным, нормальным или даже превышать верхнюю границу нормы, при этом его биологическая активность будет снижена.
Основными процессами, которые лежат в основе развития гипотиреоза у взрослых, являются либо разрушение ткани щитовидной железы со снижением ее функциональной активности (аутоиммунный тиреоидит, оперативное удаление щитовидной железы, деструктивные тиреоидиты), либо нарушение синтеза тиреоидных гормонов (врожденные дефекты биосинтеза тиреоидных гормонов, тяжелый дефицит или избыток йода), либо медикаментозное или токсическое воздействие на щитовидную железу (тиреостатики, препараты лития, перхлорат, амиодарон). Наиболее часто гипотиреоз является исходом аутоиммунного тиреоидита, операции на щитовидной железе и лечения радиоактивным йодом.
Нередко первичный гипотиреоз сочетается с синдромом галактореи-аменореи и нарушениями в репродуктивной сфере. При обследовании у таких больных выявляют повышенный уровень пролактина и признаки микро- или макроаденомы гипофиза. Патогенез развития данного синдрома связан с увеличением синтеза тиролиберина в ответ на гипотироксинемию и его стимулирующим действием на секрецию пролактина.
Приобретенный гипотиреоз развивается в основном вследствие аутоиммунного тиреоидита, оперативных вмешательств на щитовидной железе.
В качестве профилактики данных состояний Американская Терапевтическая Ассоциация рекомендует проводить скрининг ТТГ, начиная с 35 лет с интервалом 5 лет. У беременных такое исследование должно проводиться как можно раньше. У пациентов старше 60 лет — ежегодно. Необходимо учитывать, что пациент может принимать медикаменты или иметь заболевание, искажающие уровень ТТГ. Кроме того, малоинформативно определение ТТГ у лиц, находящихся в крайне тяжелом (шоковом, терминальном) состоянии.
Профилактика заболеваний щитовидной железы с помощью фитотерапии
При лечении заболеваний щитовидной железы следует уделять внимание коморбидности заболевания и полипрагмазии. С целью снижения лекарственной нагрузки на пациента следует отдавать предпочтение фитотерапии заболеваний щитовидной железы с помощью лапчаткой белой и инновационным БАДам на ее основе, как например ТИРЕО-ВИТ.
Лапчатка белая – это редкое лекарственное растение, занесенное в Красную книгу почти во всех европейских странах. К счастью, в России появились с/х предприятия, которые стали ее выращивать в промышленных масштабах. Одним из таких мест являются села Кулясово и Мамадыш Камешкирского района Пензенской области.
Действующим началом лапчатки белой являются элементарный йод и анион йодистой кислоты. Лапчатка белая также содержит иридоиды, сапонины, фенолкарбоновые кислоты, флавоноиды (кверцетин), дубильные вещества. Лапчатка белая является концентратором Mn, Zn, Cu, Se, Co, Fe, Si, Al. Лапчатка белая проявляет свою активность при всех формах тиреозов, как гиперфункции , так и гипофункциях. В связи с таким сложным составом лапчатки белой , Пензенским предприятием «Парафарм» была предложена технология криообработки корня лапчатки белой, которая позволила использовать цельный корень с сохранением всех его свойств в составе выпускаемого препарата Тирео-вит.
Состав Тирео-вита на 1 таблетку : криопорошок лапчатки белой -50мг, криопорошок эхинацеи пурпурной – 10мг, криопорошок ламинарии сахаристой -10мг, вспомогательные компоненты. По классификации токсичности растений – указанные лекарственные растения входят в самую последнюю группу малотоксичных растений!
Объяснение необходимости трехкомпонентности состава Тирео-Вита следующее.
Эхинацея богата селеном. Лапчатка белая и ламинария богаты йодом. Дефицит йода и селена в организме вызывает нарушение функций щитовидной железы. Йод и селен выступают синергистами образования в организме гормона трийодтиронина(Т3) , который активнее тироксина в десятки раз . Для преобразования Т4 в Т3 нужен селен поскольку он входит в состав фермента дийодиназа, которая превращает Т4 в Т3 . Поэтому основной причиной нарушений функции щитовидной железы является совместный дефицит йода и селена.
Корни и корневища лапчатки белой содержат соединения йода, способствующие выработке в организме гормона Т4, а также значительное число жизненно важных макро— и микроэлементов, аминокислот, углеводов, флавоноидов.
Ламинария содержит большое количество йода, бора и брома, является природным донатором таких важных элементов, как железо, кальций, натрий, цинк, литий, фосфор, ванадий и многих других. Включает витамины А, С, D, Е и многие из группы В, большое количество аминокислот, необходимых для клеточного обмена (аспарагин, лизин, аргинин др.), а также насыщенные жирные кислоты, альгинаты (вещества, обладающие мощным абсорбирующим, т.е. связывающим, действием), полисахариды, фруктоза, пектины, стерины. Благотворно влияет на состояние щитовидной железы.
Эхинацея пурпурная содержит селен, железо, кальций, калий, магний, алюминий, хлор и другие микро и макроэлементы, витамины А и С, органические кислоты (кофейная, цикориевая, молочная и др.) и эфирные масла. Благодаря своему уникальному химическому составу является сильнейшим антиоксидантом, способствуя очищению организма и обновлению клеточной структуры
Таким образом Тирео-вит является – эффективным регулятором нарушений функции щитовидной железы и оказывает восстанавливающее действие на тиреоциты. Показан детям и особенно пожилым людям в качестве безопасной альтернативы химическим препаратам.
Принимать Тирео-вит по 3 таблетки 3 раза в день за 20 минут до приёма пищи или через 30 минут после приёма пищи. Продолжительность курса –– 1 месяц. При большинстве видов тиреозов длительность приёма составляет 6–9 месяцев без перерыва.
При неблагоприятных экологических факторах, влияющих на щитовидную железу, рекомендуется профилактический приём по 2 таблетки на ночь.
Для пациентов, принимающих препараты L-тироксина (заместительная терапия), рекомендуется следующая схема приёма: постепенное увеличение дозировки «Тирео-Вита» на 1 таблетку в день с одновременным уменьшением дозы L-тироксина или пропуском в его приёме. Начинать надо с 1 таблетки на ночь.
Последствия заболеваний щитовидной железы
Литература
- Захария А. В. Исследования лапчатки белой, как перспективного средства для лечения заболеваний щитовидной железы: Автореф. дис. канд. биолог. наук. – Львов, 1997.
- Гриценко О.М., Смик Г.К. Фiтохiмiчне дослiджения перстачу бiлого // Фармацевтичний журнал. – 1977.- № 1.- С. 88.
- Каюкова В.А. Эксперимент с лапчаткой оправдал надежды // Народный доктор. – № 16. – 2004.
- Лавренов В.К., Лавренова Г.В. Полная энциклопедия лекарственных растений. Том 1. – СПб., М., 1999. – 736 с.
- Лоос С.М. Бiохiмiчнi особливостi перстача бiлого // Iнтродукцiя та аклiматизацiя рослин на Украiнi.- Киiв, 1979.- Вып. 14.- С. 101-104.
- Приходько Е. И. Лечение больных тиреотоксикозом травой перстач белый// Врачебное дело, № 6, 1976.
- Рупасова Ж.А., Игнатенко В.А., Василевская Т.И., Сидорович Е.А., Кузьменкова С.М. Сравнительная оценка накопления фенольных соединений в надземных органах лапчатки в условиях Беларуси // Бюллетень Главного ботанического сада. – Вып. 183 – 2002.
- Семенова Е.Ф., Преснякова Е.В. Химический состав лапчатки белой и применение ее с лечебной целью // Химия и компьютерное моделирование. Бутлеровские сообщения. №5, 2001.
- Слука Е.Т., Дачишин М.А. Сравнительное фитохимическое изучение некоторых видов лапчатки, произрастающих во Львовской области // Тезисы докладов 3-го съезда фармацевтов УССР. Харьков, 1979. С. 253-254.
- Смик Г.К., Кривенко В.В. Перстач бiлий – ефективный засиб для ликування захворювань щитовидноi залози/ Фармацевтичний журнал, №2, 1975, с.58-62.
- Смык Г.К. Использование лапчатки белой как нового лекарственного растения, восстановление запасов её в природе и возможности культуры // Новые культуры в народном хозяйстве и медицине: В 2 ч. – 1976. – Ч 1. – С. 41-42.
- Смык Г.К., Меньшова В.А., Корпачев В.В. Опыт вегетативного размножения Potentilla alba L.// Растительные ресурсы, т. XVIII, вып. 2, 1982.
- Современная фитотерапия / Под. ред. В.Петкова. София, 1988. 504 с.
- Стоянов Н. Нашите лекарствени растения: В 2 ч. 2-е изд. София, 1972. Ч.1. 542 с; 1973. Ч.2. 551 с.
- Струков В.И.,Курашвили Л.В., Лавров А.Н., Максимова М.Н., Елистратов Д.Г. Тирео-вит эффективный регулятор нарушений функции щитовидной железы и кальциевого обмена. Учебное пособие. Пенза-2013.
ПОЛЕЗНО УЗНАТЬ:






